原位生物打印也被称为“体内”生物打印[1],目的是在原位修复和重建有缺损的组织[2⁃4]。皮肤作为人体最大、最浅表的器官,已经成为原位生物打印的最基础且最有潜力的研究模型[5⁃7]。在原位生物打印技术中,可光聚合生物材料——甲基丙烯酸酐化明胶(GelMA)是目前应用最广泛的生物墨水基质,其不仅具有天然 ECM 的良好生物相容性[8⁃10],而且物理性质可以改变,兼具合成材料的稳定性和可重复性,因此被广泛应用于组织工程和再生医学领域研究中[11⁃13]。虽然 GelMA 有诸多优点,但是将原位成形后的 GelMA 应用于猪全层皮肤缺损创面,组织的血管化不足阻碍进一步组织修复[14]。为解决这个问题,研究者将 FGF、内皮集落形成细胞和间充质干细胞加入 GelMA 中以促进大鼠颅骨愈合过程中和小鼠体内的血管生成,但生长因子等快速降解会使其促血管化的效果大打折扣,细胞成分的安全性和伦理问题也制约其应用[15⁃17]。因此,亟待寻找一种可以稳定存在、安全性好且促血管化效果显著的生物墨水添加剂。
氧化石墨烯(GO)是一种二维碳质纳米材料,呈六方碳结构,能够提高一些天然聚合物的机械强度和导电性[18⁃19],同时有较好的生物相容性,能促进细胞增殖和黏附[20⁃22],因此在生物研究领域具有广泛的应用前景。研究表明,用 GO 处理人脐静脉血管内皮细胞(HUVEC)可以使大鼠颅骨缺损区血管网数量显著增加[23];另有研究表明,GO 可使 HUVEC内产生活性氧自由基,激活一氧化氮信号通路,促进小鸡绒毛尿囊膜中的血管生成[21,24]。但将 GO 用于治疗皮肤创面是否具有理想的原位修复和血管化效应,以及该生物学效应是否与生长因子相关,目前尚无定论。因此,本研究首先分析 GO 对人皮肤 Fb(HSF)和 HUVEC 生物学行为的影响,并明确可用于创面治疗的 GO 浓度范围;其次制备了原位光聚合的含有GO 的 GelMA 水凝胶敷料,并观测其在大鼠全层皮肤缺损创面治疗中的原位修复效应和促血管化效应;最后通过观察创面的病理学改变,对血管化效应与 GO-GelMA 复合水凝胶的关系进行初步探讨。
1 材料与方法
本实验研究经解放军总医院伦理委员会审批通过(批号:伦审第 S2020-120-01 号),遵循国家和解放军总医院有关实验动物管理和使用的相关规定。
1. 1 动物及主要材料来源
16 只健康无特殊病原体级 6 周龄体重 20 g 雌性C57BL/6 小鼠,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0040。GelMA 及光引发剂(主要成分:伊红 Y、三乙醇胺和 1-乙烯基-2-吡咯烷酮)由中国科学院理化技术研究所黄星助理研究员提供。0. 2 mg/mL GO 由北京科技大学材料科学与工程学院牛康民教授提供。HSF 和 HUVEC 及其专用培养基购自赛百慷(上海)生物技术股份有限 公 司 。 兔 抗 小 鼠 VEGFA 单 克 隆 抗 体 购 自 美 国Abcam 公司,二氨基联苯胺(DAB)显色试剂盒、辣根过氧化物酶标记的山羊抗小鼠/兔 IgG 聚合物购自北京中杉金桥生物技术有限公司 ,小 鼠 VEGF 的ELISA 检测试剂盒购自武汉基因美生物科技有限公司,细胞计数试剂盒 8(CCK-8)和 HE 染色试剂盒购自上海碧云天生物技术有限公司,医用胶布购自江苏广益医用敷料有限公司。BBD 6620 型二氧化碳培养箱购自美国 Thermo Fisher Scientific 公司,Spark 10M 型 多 功 能 酶 标 仪 购 自 瑞 士 TECAN 公 司 ,BM14000 型倒置荧光显微镜购自德国 Leica 公司,PeriCam PSI D005 型 激 光 多 普 勒 血 流 仪 购 自 瑞 典Perimed 公司,BX43 型光学显微镜购自日本 Olympus公司 ,S-4300 型场发射扫描电子显微镜购自日本HITACHI 公司。
1. 2 GO 的理化性质
将 50 μL 质量浓度为 0. 2 mg/mL 的 GO 溶液均匀涂抹一薄层于导电胶上,将其烘干后置于 500 倍场发射扫描电子显微镜下观测 GO 的结构和大小。
1. 3 GO 对 HSF 和 HUVEC 生物学行为的影响
1. 3. 1 GO 对 HSF 的 细 胞 毒 性取 100 μL 的 HSF 悬液于 96 孔板中,用 HSF 专用培养基培养,每孔 5 000 个细胞,将培养板放在 37 ℃、含体积分数5% 二氧化碳培养箱中预培养(培养条件下同)24 h。将 细 胞 分 成 0 μg/mL GO 组 、0. 1 μg/mL GO 组 、1. 0 μg/mL GO 组、5. 0 μg/mL GO 组、10. 0 μg/mL GO组,每组 6 孔,分别加入终质量浓度分别为 0(不加GO 溶液,下同)、0. 1、1. 0、5. 0、10. 0 μg/mL 的 GO 溶液,常规培养 48 h。每孔加 10 μL CCK-8 溶液,继续常规培养 1 h,用酶标仪测定波长 450 nm 处的吸光度值,以此表示 HSF 增殖活性。本实验重复 3 次。
1. 3. 2 GO 对 HSF 和 HUVEC 迁移的影响 分别用 HSF 和 HUVEC专用培养基调整HSF和 HUVEC浓度为 2×105个/mL并接种于 6 孔板中,每孔2 mL,将 2 种细胞分别分为 0 μg/mL GO 组、0. 1 μg/mL GO组、1. 0 μg/mL GO 组、5. 0 μg/mL GO 组,每组 3 孔。细胞贴壁后弃去原有培养基,使用规格为 200 μL 移液器枪头在培养孔正中垂直于培养孔划一竖痕,用PBS 清洗后,每孔加入 2 mL 含 GO 的含终体积分数1% 胎牛血清的相应细胞的专用培养基,各组细胞中加入的GO终质量浓度分别为0、0. 1、1. 0、5. 0 μg/mL。于 50 倍倒置荧光显微镜下(非荧光条件)观察划痕后 24、36 h HSF 及划痕后 12 h HUVEC 的迁移情况并采集图片,每组 HSF 选 5 个视野,每组 HUVEC 选3 个视野,采用 Image J 1. 8. 0 图像分析软件(美国国立卫生研究院)计算剩余划痕面积。计算 HSF 划痕后 24、36 h 和 HUVEC 划痕后 12 h 的迁移率。细胞迁移率=(初始划痕面积−划痕后各时间点剩余划痕面积)÷初始划痕面积×100%。本实验重复 3 次。
1. 3. 3 GO 对 HSF 分泌 VEGF 的影响 将 HSF 接种于直径为 6 cm 的培养皿中,用HSF专用培养基培养,每皿细胞数为 5×105个,共4 皿,分别为0 μg/mLGO组、0. 1 μg/mL GO组、1. 0 μg/mL GO组、5. 0 μg/mLGO 组。细胞贴壁后弃去原有培养基,分别加入含GO 终 质 量 浓 度 分 别 为 0、0. 1、1. 0、5. 0 μg/mL 的HSF 专用培养基,每皿 4 mL,同前常规培养,分别于培养 4、6、8 h 后,每皿收集 200 μL 细胞培养上清液于无菌管中,以离心半径 8. 0 cm、3 000 r/min 离心20 min 左右。按照小鼠 VEGF ELISA 试剂盒说明书进行操作 ,检测波长450 nm 下的吸光度值 ,计算VEGF 表达水平。本实验重复 3 次。
1. 4 GO-GelMA 复合水凝胶的制备和性状观察以及复合水凝胶中 GO 的释放
1. 4. 1 GO-GelMA 复合水凝胶的制备及性状观察取1 g GelMA,加入 10 mL 配制的光引发剂溶液中,放入 37 ℃水浴锅使 GelMA 充分溶解,经孔径0. 22 μm 的过滤器过滤,得到无菌的 GelMA。配制质量浓度分别为 0、0. 1、1. 0、5. 0 μg/mL 的 GO 溶液,混入 GelMA 后,得到含 4 种不同终质量浓度 GO 的GO-GelMA 复合水凝胶,分别为 0 μg/mL GO 复合水凝胶组 、0. 1 μg/mL GO 复合水凝胶组 、1. 0 μg/mLGO 复合水凝胶 组、5. 0 μg/mL GO 复合水凝胶组 。取 4 组复合水凝胶于透明玻璃瓶中,每组 1 mL,使用发光二极管(LED)白光照射 2 min 进行交联,观察交联前后复合水凝胶的性状。
1.4.2 GO-GelMA复合水凝胶中GO 的释放
1.4.3 制备的0 μg/mL GO 复合水凝胶组、0. 1 μg/mLGO 复 合 水 凝 胶 组、1. 0 μg/mL GO 复 合 水 凝 胶 组、5. 0 μg/mL GO 复合水凝胶组 GO-GelMA 复合水凝胶 ,每 组 0. 1 mL,置 于 直 径 3 cm 的 培 养 皿 中 ,于37 ℃在 1 mL PBS 中浸泡 3、7 d,取出后将复合水凝胶烘干并称其重量(W2 )。另取 4 组复合水凝胶各0. 1 mL,烘干后称其重量(W1 )。计算复合水凝胶中GO 的释放量,GO 的释放量=(W1−W2)÷W1×100%×复合水凝胶体积×GO 质量浓度。4 组样本数均为 3。
1. 5 原位光聚合 GO-GelMA 复合水凝胶在小鼠全层皮肤缺损创面中的作用
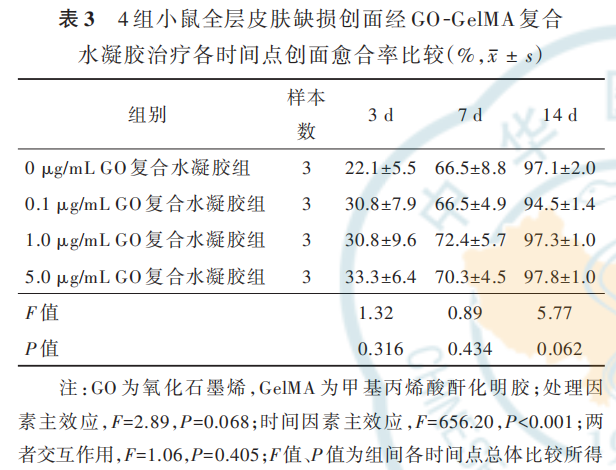
1. 5. 1 小鼠背部全层皮肤缺损创面模型的建立及分组处理 取 16 只小鼠,称重后按 50 mg/kg 腹腔注射 20 g/L 戊巴比妥钠麻醉,于每只小鼠背部正中制备直径 1 cm 的圆形全层皮肤缺损创面。将小鼠分为 0 μg/mL GO 复合水凝胶组、0. 1 μg/mL GO 复合水凝胶组、1. 0 μg/mL GO 复合水凝胶组、5. 0 μg/mLGO 复合水凝胶组,每组 4 只。伤后即刻在背部创面滴加 100 μL 含相应终质量浓度 GO 的复合水凝胶,然后使用 LED 白光照射 2 min 进行原位交联。外用医用胶布覆盖并包扎固定,持续治疗 14 d。创面每2 天更换医用胶布 1 次,保证水凝胶敷料处于湿润状态且持续覆盖于创面。
1. 5. 2 创面大体观察和创面愈合率每组各取3 只 小 鼠 ,于 治 疗 0(即 刻)、3、7、14 d 拍 照 ,采 用Image J 1. 8. 0 图像分析软件测量创面面积,并计算治疗 3、7、14 d 的创面愈合率。创面愈合率=(治疗0 d 创面面积−治疗各时间点创面面积)÷治疗 0 d 创面面积×100%。
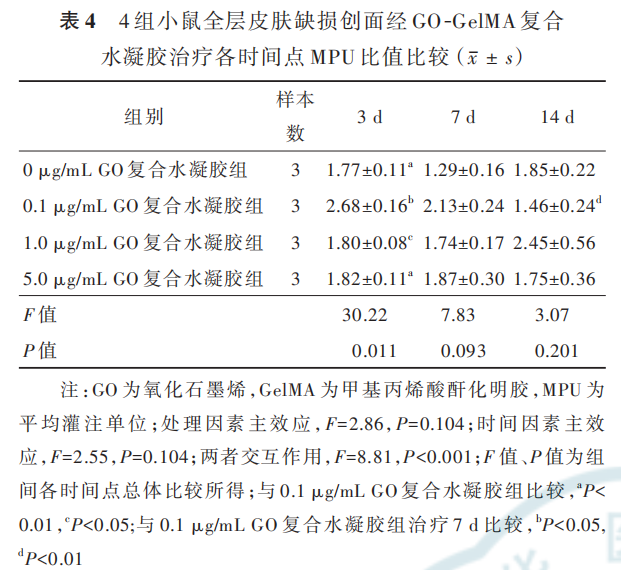
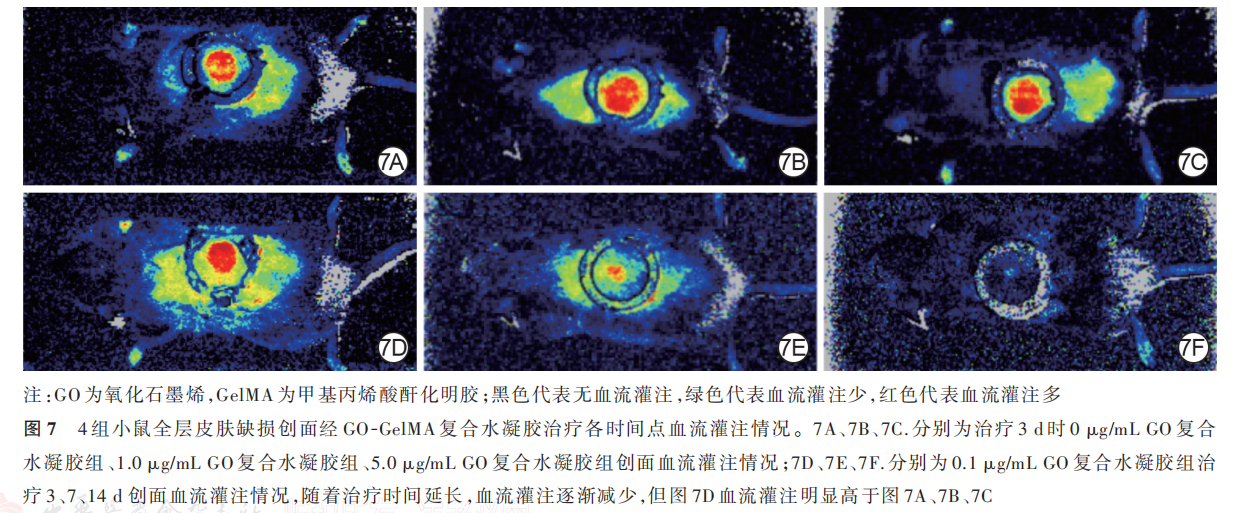
1. 5. 3 创面血流灌注每组各取 3 只小鼠,于治疗 3、7、14 d,使用激光多普勒血流仪检测创面血流灌注。激光多普勒血流仪使用不可见近红外激光(785 nm)产生散斑图案,通过分析散斑图案的变化计算平均灌注单位(MPU),血流灌注情况通过直观观察:黑色代表无血流灌注,绿色代表血流灌注少,红色代表血流灌注多。激光多普勒血流仪操作要求:(1)每次测量在同一位置,保持同样的光线及温度条件,由同一人操作;(2)每次测量区域固定,即测量面积为 0. 25 cm2 的创面区域和距创缘0. 5 cm处面积为 0. 25 cm2 的正常组织区域;(3)测量时仪器与 测 量 部 位 垂 直 ,垂 直 距 离 为(10. 0±0. 5)cm。 用MPU 比值来量化创面的血流灌注,MPU 比值=创面中心 MPU÷距创缘 0. 5 cm 的正常组织 MPU。
1. 5. 4 创面组织病理学观察
1. 5. 4. 1 HE 染色观察创面血管新生情况及 GO 分布与新生血管的位置关系治疗 7 d,每组各取1 只小鼠,采用颈椎脱臼法处死并收集背部创面及距创缘 0. 5 cm 内的组织,用 40 g/L 多聚甲醛固定,进行常规石蜡包埋、切片(厚度为 5 μm),60 ℃下烘烤4 h。将切片浸在二甲苯中脱蜡 2次,每次 10 min;然后用梯度乙醇进行脱水。加入苏木精染液染色 5 min,水洗后,加入乙醇盐酸溶液分化 3 s,水洗,加入伊红溶液染色 1 min 后,水洗。用梯度乙醇脱水,并用二甲苯透明 2 次,每次 1 min,最后用中性树胶封片并盖上盖玻片。取 4 组小鼠组织切片,于 200 倍光学显微镜下观察并计算创面组织新生血管密度(每组选 取 3 个 视 野);取 0 μg/mL GO 复 合 水 凝 胶 组 和0. 1 μg/mL GO 复合水凝胶组组织切片,于 400 倍光学显微镜下观察 GO 分布与新生血管的位置关系。1. 5. 4. 2 免疫组织化学染色检测创面组织 VEGF的表达 取 1. 5. 4. 1 制作的治疗 7 d 的 0 μg/mLGO 复合水凝胶组和 0. 1 μg/mL GO 复合水凝胶组组织切片、烘烤、脱蜡及梯度乙醇脱水,加入内源性过氧化物酶阻断剂,用体积分数 5% 山羊血清室温封闭 1 h。滴加兔抗小鼠 VEGFA 单克隆一抗(稀释比为 1∶200),4 ℃孵育过夜后,37 ℃复温 30 min,PBS冲洗;滴加辣根过氧化物酶标记的山羊抗小鼠/兔IgG 聚合物,室温孵育 20 min。PBS 冲洗后加入适量新鲜配制的 DAB 显色液,室温孵育 2 min,加入苏木精染色液孵育 2 min。将组织用梯度乙醇脱水并用二甲苯透明 2 次,每次 1 min,最后用中性树胶封片并盖上盖玻片封固,于 400 倍光学显微镜下观察创面组织 VEGF 的表达(阳性染色为深褐色)。
1. 6 统计学处理
采用 SPSS 24. 0 统计软件进行分析。所有计量资料数据均符合正态分布,以 xˉ ± s 表示。多组多个时间点总体比较行重复测量方差分析,多组单一时间点总体比较采用单因素方差分析,组间及组内两两 比 较 采 用 Tukey 法 。 P<0. 05 为差异有统计学意义。
2 结果
2. 1 GO 的理化性质
GO 为多层片状结构,宽度约为 20 μm、长度约为 50 μm。见图 1。

2. 2 GO 对 HSF 和 HUVEC 生物学行为的影响
2. 2. 1 GO 对 HSF 增殖活性的影响 培养 48 h,0. 1 μg/mL GO 组、1. 0 μg/mL GO 组、5. 0 μg/mL GO组 HSF 的吸光度值与 0 μg/mL GO 组无明显差别(q值 分 别 为 0. 31、3. 44、3. 19,P 值 分 别 为 >0. 999、0. 140、0. 192);10. 0 μg/mL GO 组 HSF 的吸光度值明显低于 0 μg/mL GO 组(q=7. 64,P<0. 001),故后续实验中弃用 10. 0 μg/mL GO。见图 2。
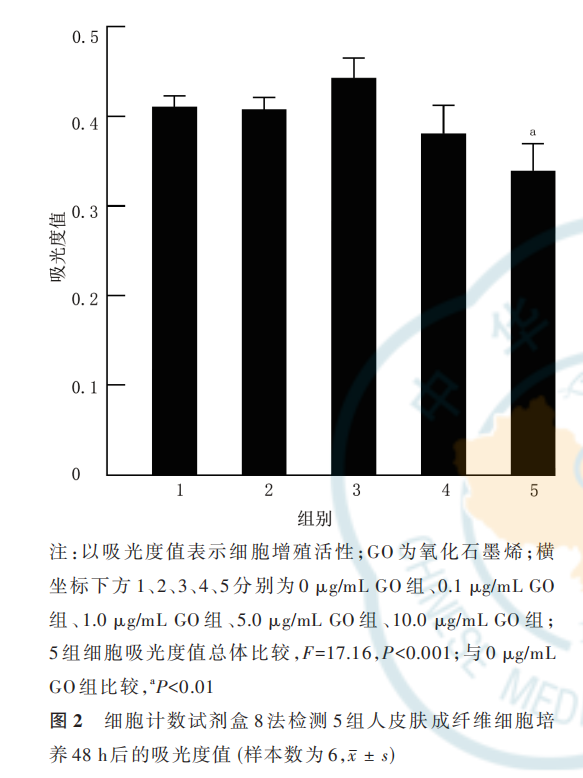
2. 2. 2 GO 对 HSF 和 HUVEC 迁移的影响 划痕后 24 h,4 组 HSF 迁移率总体比较,差异无统计学意义(P>0. 05)。划痕后 36 h,0. 1 μg/mL GO 组 HSF 迁移率最高,明显高于 0 μg/mL GO 组、1. 0 μg/mL GO组 、5. 0 μg/mL GO 组(q 值 分 别 为 7. 48、10. 81、10. 20,P 值均<0. 001),而 0 μg/mL GO 组 HSF 迁移率与 1. 0 μg/mL GO 组、5. 0 μg/mL GO 组无明显差异(q 值分别为 3. 33、2. 72,P 值分别为 0. 107、0. 240),1. 0 μg/mL GO 组和 5. 0 μg/mL GO 组 HSF 迁移率无明显差异(q=0. 61,P=0. 973)。见图 3、表 1。
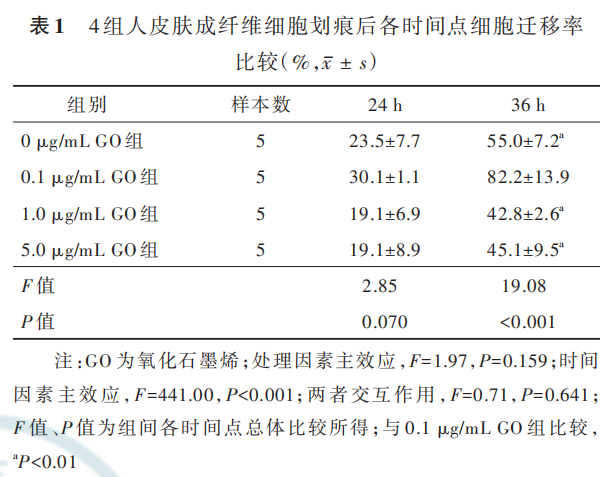

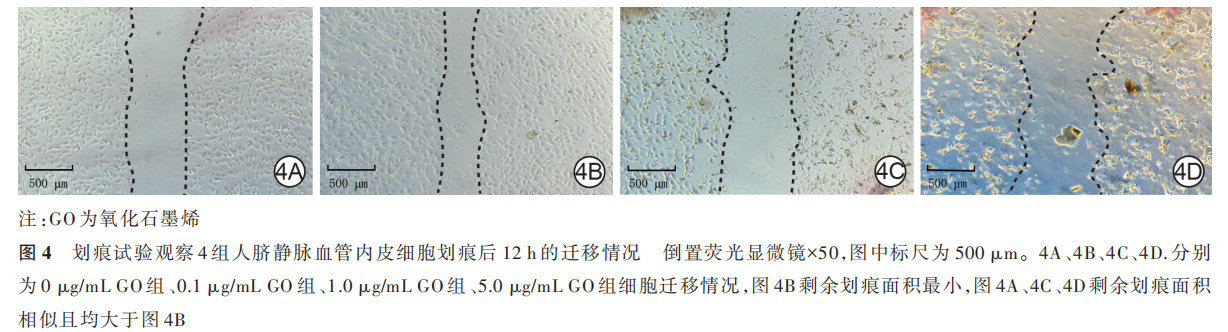
划痕后 12 h,0 μg/mL GO 组、0. 1 μg/mL GO 组、1. 0 μg/mL GO 组、5. 0 μg/mL GO 组 HUVEC 的迁移率 分 别 为(20. 6±3. 3)% 、(39. 1±4. 7)% 、(15. 7±5. 8)%、(3. 0±1. 6)%,组间总体比较,差异明显(F=37. 78,P<0. 001)。0. 1 μg/mL GO 组 HUVEC 的迁移率明显高于 0 μg/mL GO 组、1. 0 μg/mL GO 组以及5. 0 μg/mL GO 组(q 值分别为 7. 11、8. 99、14. 92,P 值分 别 为 0. 005、0. 001、<0. 001),1. 0 μg/mL GO 组HUVEC 迁 移 率 和 0 μg/mL GO 组 无 明 显 差 异(q=1. 88,P=0. 573),5. 0 μg/mL GO 组 HUVEC 迁移率明显低于 0 μg/mL GO 组和 1. 0 μg/mL GO 组(q 值分别为 7. 81、5. 33,P 值分别为 0. 003、0. 023)。见图 4。
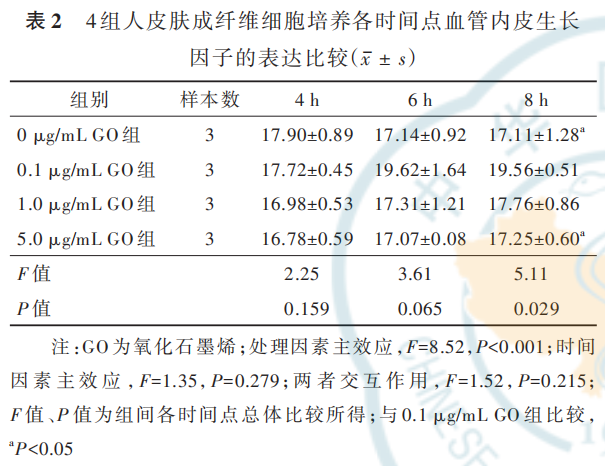
2. 2. 3 GO 对 HSF 分 泌 VEGF 的 影 响 培 养 4、6 h,4 组 HSF 的 VEGF 表达均相近(P>0. 05)。培养8 h,0. 1 μg/mL GO 组 HSF 的 VEGF 表 达 明 显 高 于0 μg/mL GO 组 和 5. 0 μg/mL GO 组(q 值 分 别 为4. 75、4. 48,P 值分别为 0. 013、0. 020),与 1. 0 μg/mLGO 组无明显差异(q=3. 50,P=0. 090);0 μg/mL GO组 HSF 的 VEGF 表达和 1. 0 μg/mL GO 组、5. 0 μg/mLGO 组无明显差异(q 值分别为 1. 26、0. 27,P 值分别为 0. 811、0. 997);1. 0 μg/mL GO 组 HSF 的 VEGF 表达 和 5. 0 μg/mL GO 组 无 明 显 差 异(q=0. 98,P=0. 898)。见表 2。
2. 3 GO-GelMA 复合水凝胶的性状及 GO 的释放
2. 3. 1 GO-GelMA 复合水凝胶的性状 0 μg/mL GO 复 合 水 凝 胶 组、0. 1 μg/mL GO 复 合 水 凝 胶 组、1. 0 μg/mL GO 复合水凝胶组、5. 0 μg/mL GO 复合水凝胶组复合水凝胶在交联前均呈红色液体状,交联后呈微黄色凝胶状,且 5. 0 μg/mL GO 复合水凝胶组复合水凝胶交联后颜色最深。4 组复合水凝胶交联后的流动性无明显差异,见图 5。

2. 3. 2 GO-GelMA 复合水凝胶中 GO 的释放 浸泡 3、7 d,0 μg/mL GO 复合水凝胶组复合水凝胶中均无 GO 释放。浸泡 3 d,0. 1 μg/mL GO 复合水凝胶组、1. 0 μg/mL GO 复合水凝胶组、5. 0 μg/mL GO 复合 水 凝 胶 组 复 合 水 凝 胶 中 GO 释 放 量 分 别 约 为0. 003、0. 031、0.166μg;浸泡7 d,0. 1 μg/mL GO复合水凝胶组、1.0μg/mL GO复合水凝胶组、5. 0 μg/mLGO 复合水凝胶组复合水凝胶中 GO 释放量分别为0. 010、0. 100、0. 500 μg,即 3 组复合水凝胶中 GO 完全释放。
2. 4 原位光聚合 GO-GelMA 复合水凝胶在小鼠全层皮肤缺损创面中的作用
2. 4. 1 创面大体观察和创面愈合率治疗 0 d,4 组复合水凝胶均在小鼠创面原位交联固化,形成半透明水凝胶敷料。治疗 3、7 d,4 组小鼠创面可见水凝胶敷料覆盖在位并保持湿润,创面均未见明显渗出且均有不同程度缩小;治疗 14 d,4 组小鼠创面均基本愈合,未见水凝胶敷料残留。治疗 3、7、14 d,4 组小鼠创面愈合率比较,差异均无统计学意义(P>0. 05)。见表 3、图 6。
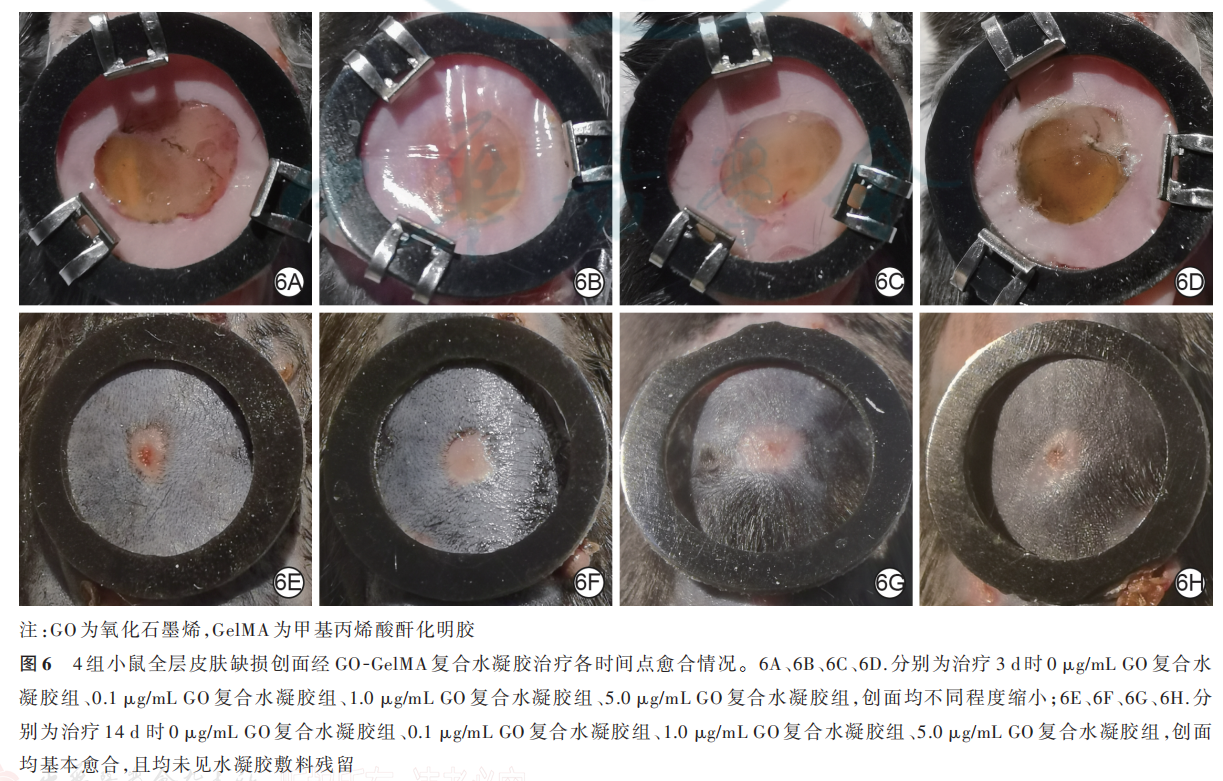
2. 4. 2 创面血流灌注治疗 3 d,0. 1 μg/mL GO复合水凝胶组小鼠创面的 MPU比值明显高于 0 μg/mLGO 复 合 水 凝 胶 组、1. 0 μg/mL GO 复 合 水 凝 胶 组、5. 0 μg/mL GO 复 合 水 凝 胶 组(q 值 分 别 为 10. 70、11.83、10. 65,P 值 分 别 为 0. 007、0. 011、0.009),0 μg/mL GO复合水凝胶组小鼠创面的MPU比值与1. 0 μg/mL GO 复合水凝胶组、5. 0 μg/mL GO 复合水凝胶组无明显差异(q值分别为0. 42、0. 75,P 值分别为 0. 989、0. 948),1. 0μg/mL GO复 合 水 凝 胶 组 和5. 0 μg/mL GO复合水凝胶组小鼠创面MPU比值无明显差异(q=0. 45,P=0. 987)。治疗 7、14 d,4 组小鼠创面的 MPU 比值总体比较,差异均无统计学意义(P>0. 05)。0. 1 μg/mL GO 复合水凝胶组小鼠创面MPU 比值在治疗 3 d 达到峰值,随后呈下降趋势;0. 1 μg/mL GO 复合水凝胶组小鼠创面治疗 7 d 的MPU 比值明显低于治疗 3 d(q=14. 38,P=0. 024),治疗 14 d 的 MPU 比值明显低于治疗 7 d(q=27. 78,P=0. 007)。见表 4、图 7。
2. 4. 3 创面组织病理学观察
2. 4. 3. 1 创面血管新生情况以及 GO 分布与新生血管的位置关系治疗 7 d,4 组小鼠创面基底均有 明 显 的 血 管 新 生 ,0 μg/mL GO 复 合 水 凝 胶 组 、0. 1 μg/mL GO复合水凝胶组、1. 0 μg/mL GO 复合水凝胶组、5. 0 μg/mL GO复合水凝胶组小鼠创面新生血 管 密 度 分 别 为 每 200 倍 视 野 下(61. 7±1. 3)、(120. 7±4. 1)、(77. 7±10. 2)、(99. 0±7. 9)根,组间总体比较,差异明显(F=28. 08,P<0. 001)。0. 1 μg/mLGO 复合水凝胶组小鼠创面新生血管密度最大,明显高于 0 μg/mL GO 复合水凝胶组、1. 0 μg/mL GO 复合水凝胶组、5. 0 μg/mL GO 复合水凝胶组(q 值分别为 12. 88、7. 79、6. 70,P 值 分 别 为 <0. 001、0. 003、0. 006),1. 0 μg/mL GO 复合水凝胶组和 5. 0 μg/mLGO 复合水凝胶组小鼠创面新生血管密度均明显高于 0 μg/mL GO 复 合 水 凝 胶 组(q 值 分 别 为 5. 10、6. 19,P 值 分 别 为 0. 029、0. 010),1. 0 μg/mL GO 复合水凝胶组和 5. 0 μg/mL GO 复合水凝胶组小鼠创面 新 生 血 管 密 度 无 明 显 差 异(q=1. 09,P=0. 865)。治疗 7 d,随着创面基底组织不断修复,0 μg/mL GO复合水凝胶组和 0. 1 μg/mL GO 复合水凝胶组水凝胶敷料均逐渐降解,且相较于 0 μg/mL GO 复合水凝胶组,0. 1 μg/mL GO 复合水凝胶组小鼠创面中可明显 看 到 有 成 簇 新 生 血 管 ,且 聚 集 于 GO 附 近 。见图 8。
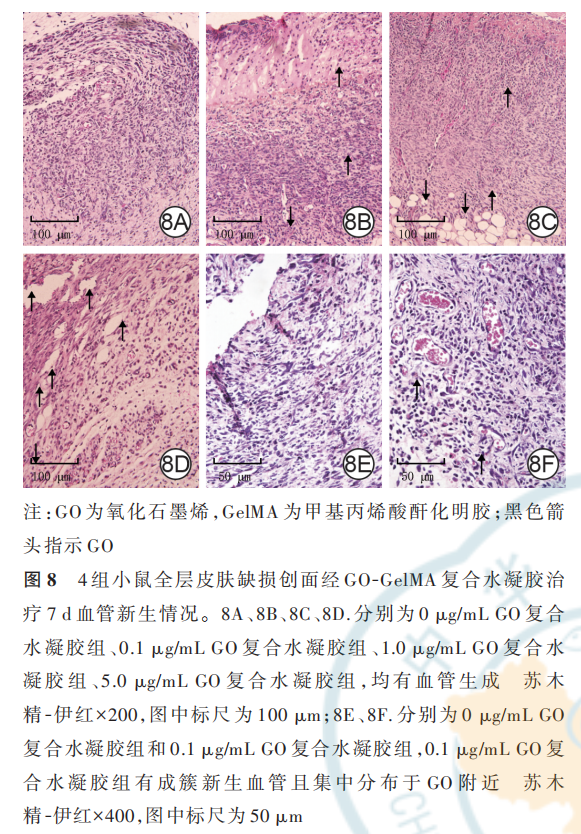
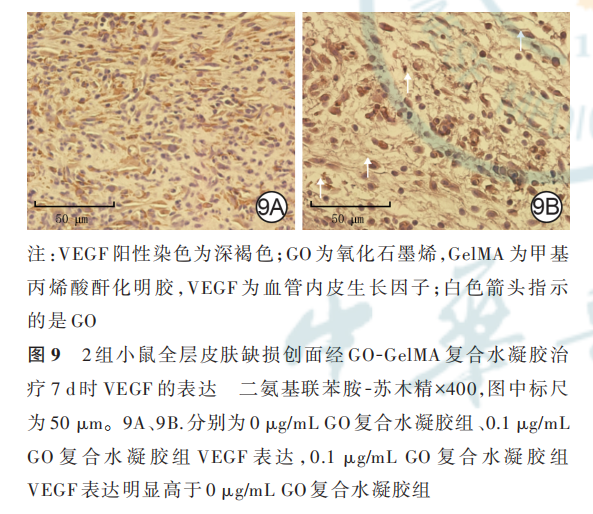
2. 4. 3. 2 免疫组织化学染色检测创面细胞 VEGF的表达治疗 7 d,相较于 0 μg/mL GO 复合水凝胶组,0. 1 μg/mL GO 复合水凝胶组小鼠创面中 GO和新生血管分布区域有大量 VEGF 表达。见图 9。
3 讨论
GelMA 因为其良好的生物相容性和可调的物理特性,被广泛应用于各种生物医学领域,皮肤作为人体最大、最易触及的浅表器官,使得 GelMA 在其 中 的 应 用 更 为 方 便 和 广 泛[25⁃26],但 是 单 纯 采 用GelMA 治 疗 创 面 无 法 促 进 创 面 床 血 管 化。Vedakumari等[27] 研究表明,GO 可用于诱导鸡胚血管生成实验中的血管生成,治疗血管生成不足疾病,但是目前对于促进血管生成的GO 浓度还存在争议,即不同的 GO 浓度可能会对血管生成起到不同的 作 用[21,28⁃29],而 且 缺 乏 GO 创 面 血 管 化 的 体 外 研究,因此本研究制备 GO-GelMA 复合水凝胶敷料并对其促进小鼠全层皮肤缺损创面的血管化效果进行初探。
首先,本课题组通过场发射扫描电子显微镜观察到 GO 为多层片状结构,宽度约为 20 μm、长度约为 50 μm。本课题组接着研究了 GO 对 HSF 增殖活性的影响,结果显示 GO 质量浓度为 10. 0 μg/mL 时会对细胞增殖活性有明显抑制作用,可能是因为GO 通过促进细胞产生较多线粒体活性氧自由基,从而诱导细胞死亡[30],因而后续实验研究排除使用10. 0 μg/mL 的 GO。随后,本研究进行划痕试验,结果显示 GO 质量浓度为 0. 1 μg/mL 时能够促进 HSF和 HUVEC 迁移;ELISA 实验结果显示,GO 质量浓度为 0. 1 μg/mL 时能促进 HSF 分泌 VEGF。总之,细胞实验表明 GO 质量浓度为 0. 1 μg/mL 时,对细胞的增殖、迁移和分泌 VEGF 均具有明显的促进作用,而1. 0、5. 0 μg/mL 的 GO 对 HSF 没有细胞毒性,同时对HSF 增殖活性没有明显影响。
然 后 ,本 研 究 制 备 含 GO 质 量 浓 度 分 别 为 0、0. 1、1. 0、5. 0 μg/mL 的 GO-GelMA 复合水凝胶,白光照射 2 min 后 4 组水凝胶均能成功交联固化,形成微黄色凝胶状水凝胶敷料,说明加入 GO 后不会影响GelMA 交联。研究表明,加入低于 5. 0 μg/mL 的 GO后 GelMA 水凝胶的黏度、杨氏模量等物理性能与单纯 GelMA 水凝胶相近[31],因此含不同质量浓度 GO的 GO-GelMA 复合水凝胶敷料的生物学效应的差异主要归因于 GO 浓度。本研究检测了复合水凝胶中GO 的释放,结果显示,至 7 d 时包裹在不同复合水凝胶中的 GO 全部释放。
本 研 究 接 着 将 制 备 的 含 不 同 质 量 浓 度 GO 的GO-GelMA 复合水凝胶敷料用于治疗小鼠背部全层皮肤缺损创面,但 4 组小鼠治疗各时间点创面愈合率比较,差异无统计学意义(P>0. 05),说明含不同质量浓度 GO 的 GO-GelMA 复合水凝胶敷料对创面愈合的效果相近。但创面血流灌注的检测显示,0. 1 μg/mL GO 复合水凝胶组小鼠创面治疗 3 d 的MPU 比值明显高于其他 3 组;0. 1 μg/mL GO 复合水凝胶组小鼠创面 MPU 比值在治疗 3 d 达到峰值,随后逐渐下降。创面修复过程主要包括 3 个阶段:炎症期、新组织生成期和重塑期,小鼠背部创面的新组织生成期为伤后 2~10 d,血管生成主要发生在这一阶段[32⁃34]。本部分实验结果表明,0. 1 μg/mL GO复合水凝胶组小鼠创面治疗 7 d,即在新组织生成期的新生血管密度增加,而进入创面重塑期后 GO 不会继续增加创面新生血管的密度,即含 0. 1 μg/mLGO 的 GO-GelMA 复合水凝胶可以在新组织生成期显著促进创面血管化而不会对重塑期的创面血管化产生影响。Ridiandries 等[35] 研究表明,如果重塑期血管生成和细胞增殖过程不停止,可能会导致瘢痕形成。因此,本研究团队认为,含 0. 1 μg/mL GO的 GO-GelMA 复合水凝胶能够对创面血管化有较好的促进作用。
最后,本研究对创面组织进行 HE 染色,结果显示,随着创面修复的进展,治疗 7 d 时含 0. 1 μg/mL GO 的 GO-GelMA 复合水凝胶有明显的新生血管富集现象,说明其可促进创面血管化。免疫组织化学染色显示,GO 周围区域有大量 VEGF 表达。多项研究显示,GO 诱导的细胞内活性氧自由基(包括一氧化氮)升高会诱导多种生长因子(如VEGF 和碱性FGF 等)的信号转导级联反应[36⁃39]。研究表明,牛血清白蛋白包被的 GO 可以显著吸附 VEGF,分子动力学模拟实验表明 GO 对蛋白的吸附作用可能是由蛋白质中氨基酸残基和 GO 的官能团之间的静电相互作用驱动的[40⁃43],提示 GO 促进血管生成可能是通过促 进 细 胞 分 泌 VEGF 且 VEGF 在局部富集而实现的。
综上所述,含 0. 1 μg/mL GO 的 GO-GelMA 复合水凝胶能明显促进 HSF 和 HUVEC 迁移以及 HSF 增殖和分泌 VEGF。在不影响创面愈合率的情况下,含 0. 1 μg/mL GO 的 GO-GelMA 复合水凝胶在创面愈合的组织生成期能明显增加血流灌注,其中的GO 有促进血管生成的作用,GO 富集新生血管的作用有可能是通过增加创面 VEGF 分泌来实现的。然而含 GO 的 GO-GelMA 复合水凝胶促进创面血管化的作用机制仍需要深入研究。基于此,GO-GelMA生物墨水在再生医学领域具有广阔的应用前景。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 梁莉婷:设计实验、实施研究、采集数据、分析/解释数据、文章撰写;宋薇、李曌、姚斌:对文章的知识性内容作批评性审阅、技术和材料支持;张超、张孟德、袁星宇、恩和吉日嘎拉:实施研究、采集数据、解释数据、统计分析;付小兵、黄沙、朱平:酝酿和设计实验、研究过程指导、研究经费支持、对文章的知识性内容作批评性审阅
参考文献
[1] Guillemot F, Souquet A, Catros S, et al. High-throughput laserprinting of cells and biomaterials for tissue engineering[J].Acta Biomater, 2010, 6(7): 2494-2500. DOI: 10.1016/j. actbio. 2009.09.029.
[2] Campbell PG,Weiss LE.Tissue engineering with the aid of inkjet printers[J]. Expert Opin Biol Ther, 2007, 7(8): 1123 -1127. DOI: 10.1517/14712598.7.8.1123.
[3] Ozbolat IT. Bioprinting scale-up tissue and organ constructs fortransplantation[J]. Trends Biotechnol, 2015, 33(7): 395 -400. DOI: 10.1016/j.tibtech.2015.04.005.
[4] Li X, Lian Q, Li D, et al. Development of a robotic arm based hydrogel additive manufacturing system for in -situ printing[J]. Applied Sciences, 2017, 7(1):73. DOI:10.3390/app7010073.
[5] Singh S,Choudhury D,Yu F,et al.In situ bioprinting - bioprinting from benchside to bedside? [J]. Acta Biomater, 2020, 101: 14 -25. DOI:10.1016/j.actbio.2019.08.045.
[6] Huang R, Hu J, Qian W, et al. Recent advances in nanotherapeutics for the treatment of burn wounds[J/OL]. Burns Trauma, 2021, 9: tkab026[2022-03-14]. https://pubmed. ncbi. nlm. nih.gov/34778468/.DOI:10.1093/burnst/tkab026.
[7] Wang H, Liu Y, Cai K, et al. Antibacterial polysaccharide-based hydrogel dressing containing plant essential oil for burn wound healing[J/OL].Burns Trauma,2021,9:tkab041[2022 -03-14].https: //pubmed. ncbi. nlm. nih. gov/34988231/. DOI: 10.1093/burnst/
[8] Afewerki S, Sheikhi A, Kannan S, et al. Gelatin-polysaccharide composite scaffolds for 3D cell culture and tissue engineering: towards natural therapeutics [J]. Bioeng Transl Med , 2018, 4(1): 96 -115.DOI:10.1002/btm2.10124.
[9] Li MN, Yu HP, Ke QF, et al. Gelatin methacryloyl hydrogels functionalized with endothelin -1 for angiogenesis and fullthickness wound healing[J]. J Mater Chem B, 2021, 9(23):4700-4709.DOI:10.1039/d1tb00449b.
[10] Vandooren J,Van den Steen PE,Opdenakker G.Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9(MMP-9): the next decade[J].Crit Rev Biochem Mol Biol, 2013,48(3):222-272.DOI:10.3109/10409238.2013.770819.
[11] Jang MJ,Bae SK,Jung YS,et al.Enhanced wound healing using a 3D printed VEGF -mimicking peptide incorporated hydrogel patch in a pig model[J]. Biomed Mater, 2021, 16(4): 605. DOI: 10.1088/1748 -605X/abf 1 a 8.
[12] Loessner D, Meinert C,Kaemmerer E, et al. Functionalization,preparation and use of cell-laden gelatin methacryloyl-based hydrogels as modular tissue culture platforms [J].Nat Protoc,2016, 11(4):727 -746.DOI:10.1038/nprot.2016.037.
[13] Klotz BJ,Gawlitta D,Rosenberg AJWP,et al.Gelatin-methacryloyl hydrogels: towards biofabrication-based tissue repair[J]. Trends Biotechnol, 2016, 34(5): 394 -407. DOI: 10.1016/j. tibtech. 2016.01.002.
[14] Nuutila K, Samandari M,Endo Y, et al.In vivo printing of growth factor-eluting adhesive scaffolds improves wound healing [J]. Bioact Mater, 2022, 8: 296 -308. DOI : 10 .1016/j. bioactmat. 2021.06.030.
[15] Zhou X, Chen J, Sun H, et al. Spatiotemporal regulation of angiogenesis/osteogenesis emulating natural bone healing cascade for vascularized bone formation[J].J Nanobiotechnology, 2021,19(1):420.DOI:10.1186/s12951-021-01173-z.
[16] Chen YC,Lin RZ,Qi H,et al.Functional human vascular network generated in photocrosslinkable gelatin methacrylate hydrogels [J]. Adv Funct Mater, 2012, 22(10): 2027 -2039. DOI: 10.1002/ adfm.201101662.
[17] Lin RZ,Chen YC,Moreno-Luna R,et al.Transdermal regulation of vascular network bioengineering using a photopolymerizable methacrylated gelatin hydrogel [J]. Biomaterials , 2013 , 34(28): 6785 -6796.DOI:10.1016/j.biomaterials .2013.05.060 .
[18]Fang H, Luo C ,Liu S,et al.A biocompatible vascularized graphene oxide (GO) -collagen chamber with osteoinductive and antifibrosis effects promotes bone regeneration in vivo [J]. Theranostics, 2020 ,10(6):2759 -2772.DOI:10.7150/thno.42006.
[19]Norahan MH, Amroon M ,Ghahremanzadeh R, et al.Electroactive graphene oxide-incorporated collagen assisting vascularization for cardiac tissue engineering [J]. J Biomed Mater Res A , 2019, 107(1): 204-219 .DOI:10.1002 /jbm.a.36555.
[20]Chakraborty S,Ponrasu T , Chandel S , et al . Reduced graphene oxide - loaded nanocomposite scaffolds for enhancing angiogenesis in tissue engineering applications[J]. R Soc Open Sci,2018,5(5):172017.DOI:10.1098/rsos.172017.
[21] Mukherjee S, Sriram P, Barui AK, et al. Graphene oxides show angiogenic properties [J]. Adv Healthc Mater , 2015, 4(11):1722 -1732.DOI:10.1002 /adhm .201500155.
[22] Chang TK, Lu YC, Yeh ST, et al. In vitro and in vivo biological responses to graphene and graphene oxide: a murine calvarial animal study[J]. Int J Nanomedicine, 2020, 15: 647 -659. DOI:
[23] Liu W, Luo H, Wei Q, et al. Electrochemically derived nanographene oxide activates endothelial tip cells and promotes angiogenesis by binding endogenous lysophosphatidic acid [J]. Bioact Mater, 2022, 9: 92-104. DOI: 10.1016/j. bioactmat. 2021.07.007.10.2147/IJN.S231885.
[24]焦德龙 .功能化石墨烯/光凝胶复合载药体系用于骨组织再生 修复研究[D]. 上海:上海交通大学,2019.DOI:10.27307/d.cnki. gsjtu.2019.004439.
[25] Yue K, Trujillo-de Santiago G, Alvarez MM, et al. Synthesis, properties, and biomedical applications of gelatin methacryloyl (GelMA) hydrogels[J]. Biomaterials, 2015, 73: 254-271. DOI: 10.1016/j.biomaterials.2015.08.045.
[26] Coentro JQ, Pugliese E, Hanley G, et al. Current and upcoming therapies to modulate skin scarring and fibrosis [J]. Adv Drug Deliv Rev,2019,146:37 -59.DOI:10.1016/j.addr.2018 .08.009.
[27] Vedakumari SW,Veda Jancy SJ,Pravin YR,et al.Facile synthesis of sericin modified graphene oxide nanocomposites for treating ischemic diseases[J]. Environ Res, 2022, 209: 112925. DOI: 10.1016/j.envres.2022.112925.
[28] Verde V, Longo A, Cucci LM, et al. Anti-angiogenic and anti -proliferative graphene oxide nanosheets for tumor cell therapy[J]. Int J Mol Sci, 2020, 21(15): 5571. DOI: 10.3390/igms21155571.
[29] Lai PX,Chen CW,Wei SC ,et al.Ultrastrong trapping of VEGF by graphene oxide : anti -angiogenesis application [J]. Biomaterials, 2016,109:12 -22 .DOI :10.1016/j.biomaterials.2016.09.005.
[30] Zhang Y,Ali SF ,Dervishi E ,et al .Cytotoxicity effects of graphene and single -wall carbon nanotubes in neural phaeochromocytoma -derived PC 12 cells[J].ACS Nano,2010,4(6): 3181-3186.DOI:10.1021/nn1007176.
[31] Liang Y, Chen B, Li M, et al.Injectable antimicrobial conductive hydrogels for wound disinfection and infectious wound healing [J]. Biomacromolecules, 2020, 21(5): 1841 -1852. DOI: 10.1021/acs . biomac.9b01732.
[32] Gurtner GC, Werner S, Barrandon Y, et al. Wound repair and regeneration[J]. Nature, 2008, 453(7193): 314 - 321. DOI: 10.1038/ nature07039
[33] Li M, Zhao Y, Hao H, et al. Theoretical and practical aspects of using fetal fibroblasts for skin regeneration [J]. Ageing Res Rev, 2017,36:32 -41.DOI:10.1016/j.arr.2017.02.005 .
[34] Wang M, Wang C, Chen M, et al. Efficient angiogenesis-based diabetic wound healing/skin reconstruction through bioactive antibacterial adhesive ultraviolet shielding nanodressing with exosome release[J]. ACS Nano, 2019, 13(9): 10279-10293. DOI:10.1021/acsnano.9b03656.
[35]Ridiandries A ,Tan J,Bursill CA .The role of chemokines in wound healing [J]. Int JTM Mol Sci , 2018, 19(10): 3217. DOI: 10.3390/ijms19103217
[36] Jamieson D, Chance B, Cadenas E, et al. The relation of free radical production to hyperoxia[J]. Annu Rev Physiol, 1986, 48: 703-719.DOI:10.1146/annurev.ph.48.030186.003415.
[37] Allen RG , Balin AK . Oxidative influence on development and differentiation : an overview of a free radical theory of development[J]. Free Radic Biol Med , 1989, 6(6): 631 -661. DOI: 10.1016/0891 -5849(89)90071-3
[38]Calabrese V, Mancuso C, Calvani M,et al. Nitric oxide in the central nervous system : neuroprotection versus neurotoxicity [J]. Nat Rev Neurosci,2007,8(10):766 -775 .DOI :10.1038/nrn2214.
[39]Semenza GL .HIF- 1 and mechanisms of hypoxia sensing [J].Curr Opin Cell Biol , 2001 , 13(2): 167-171. DOI: 10.1016/s 0955 - 0674 (00)00194 -0.
[40] Chong Y, Ge C, Yang Z, et al. Reduced cytotoxicity of graphene nanosheets mediated by blood -protein coating[J]. ACS Nano, 2015,9(6): 5713-5724 .DOI:10 .1021 /nn5066606.
[41] Wei XQ , Hao LY , Shao XR , et al . Insight into the interaction of graphene oxide with serum proteins and the impact of the degree of reduction and concentration [J]. ACS Appl Mater Interfaces , 2015,7(24):13367 -13374.DOI:10 . 1021 /acsami.5b01874.
[42] Feng R, Yu Y, Shen C, et al. Impact of graphene oxide on the structure and function of important multiple blood components by a dose-dependent pattern [J]. J Biomed Mater Res A , 2015, 103(6):2006 -2014.DOI:10.1002 /jbm .a.35341.
[43] Li S,Mulloor JJ,Wang L, et al.Strong and selective adsorption of lysozyme on graphene oxide [J].ACS Appl Mater Interfaces ,2014 , 6(8):5704 -5712.DOI:10.1021 /am500254e.
本文献包括图片转载于中华烧伤与创面修复杂志 2022 年 7 月第 38 卷第 7 期,不代表本网站赞同其观点和对其真实性负责,我们主要用于阅读分享,非商业用途,如若侵权,请告知删除。


