创面若发生异常愈合可出现瘢痕挛缩而影响正常的皮肤功能和外观,因此寻找合适的创面治疗方式而避免异常愈合极为重要[1-4]。对于全层皮肤损伤的患者,皮片移植是优先考虑的创面治疗方式。皮片移植可分为由表皮和部分真皮组成的刃厚皮移植(STSG)、由表皮和全层真皮组成的全厚皮移植(FTSG)。STSG 能够在血管较少的移植部位存活,但因真皮成分较薄可能导致创面愈合后出现瘢痕和皮片挛缩。FTSG 虽然不容易出现皮片挛缩,但创 面 需 要有更好的血供才能保障较高的皮片成活率[5-10]。
目前 ,有不少研究将干细胞用于治疗皮肤创伤。干细胞可以与复合材料联合使用,也可以直接应用于创面。干细胞的特征在于其多向分化能力和自我更新能力。不少实验对不同干细胞促进伤口愈合和组织再生的能力进行检测,结果显示干细胞可以修复细胞基质、减轻炎症、增加血管生成等,证明了干细胞的使用是安全并且有效的[11-19]。本课题组前期研究观察到,伤后 7 d 异体大鼠表皮干细胞(ESC)可以在大鼠全层皮肤缺损创面床中增殖和分化;并且,大鼠 ESC 能提高全层皮肤缺损创面愈合率,而其中的机制之一是 ESC 可促进创面新生血管的增加[20]。然而,ESC 是否能影响皮片移植质量(包括血运情况和胶原形成情况等)从而影响创面愈合效果尚不清楚。本研究提取异体 ESC 应用于裸鼠全层皮肤缺损创面后移植异体全厚皮,探究ESC 对皮片移植效果的影响,为临床实现用 ESC 治疗创面提供前期科学依据。
1 材料与方法
本实验研究符合中山大学附属第一医院和国家关于动物实验的相关规定。
1. 1 动物及主要试剂与仪器来源
31 只 4 周 龄 无 特 殊 病 原 体 级 健 康 雄 性(体 重12~15 g)BALB/c-NU 裸鼠购于江苏集萃药康生物科技有限公司,许可证号:SCXK(苏)2018-0008。青霉素、链霉素购于杭州弗德生物科技有限公司,PBS、KC SFM 无血清培养基购于美国 Gibco 公司,即用型高浓度胰蛋白酶替代物 Tryple 购于美国Thermo Fisher Scientific 公 司 ,纤 维 连 接 蛋 白 、4',6-二脒基-2-苯基吲哚(DAPI)购于美国 Sigma 公司,山羊血清购于上海碧云天生物技术有限公司,兔抗小 鼠 CD44 多 克 隆 抗 体 、兔 抗 小 鼠 CD45 单 克 隆 抗体、兔 抗 小 鼠 整 合 素 6α 单 克 隆 抗 体、大 鼠 抗 小 鼠p63 多克隆抗体、大鼠抗小鼠 CD71 多克隆抗体、兔抗小鼠基质金属蛋白酶 9(MMP-9)多克隆抗体、兔抗小鼠Ⅰ型胶原单克隆抗体、大鼠抗小鼠Ⅲ型胶原多克隆抗体、大鼠抗小鼠 IL-10 多克隆抗体、兔抗小鼠 TNF-α 多克隆抗体购于美国 Abcam 公司,兔抗小鼠 IL-8 单克隆抗体、Alexa Fluor 488 标记的山羊抗兔 IgG 抗体、Alexa Fluor 594 标记的山羊抗鼠 IgG 抗体、兔抗小鼠 GAPDH 单克隆抗体购于美国 Affinity公司,辣根过氧化物酶标记的山羊抗兔 IgG 抗体和辣根过氧化物酶标记的山羊抗鼠 IgG 抗体购于美国CST 公司,抗荧光淬灭剂购于北京索莱宝科技有限公司,异氟烷购于深圳市瑞沃德生命科技有限公司,宝生物染料法荧光定量试剂盒购于日本 TaKaRa公司。
细胞分选仪购于广州市麦施缔医疗科技有限公司,HERAcell 150i 型二氧化碳培养箱购于美国Thermo Fisher Scientific 公司,BDS-200 型倒置相差显 微 镜 购 于 重 庆 奥 特 光 学 仪 器 有 限 责 任 公 司 ,CytoFLEX 型流式细胞仪购于美国 Beckman CoulterGallios 公司,LEXT OLS4500 型激光扫描共聚焦显微镜购于日本 Olympus 公司,SpectraMax i3 型多功能酶标仪购于美国 SpectraMax 公司,PeriCam PSI 型激光散斑血流成像仪购于深圳市瑞沃德生命科技有限 公 司 ,电 泳 仪 、凝 胶 成 像 分 析 系 统 购 于 美 国BioRad 公司。
1. 2 ESC 的分离培养和鉴定
取 1 只裸鼠,颈椎脱臼处死后切取背部全层皮肤,置于加入 100 万 U/mL 青霉素及 100 μg/mL 链霉素(浓度下同)的 PBS 中。去除皮肤肌肉及脂肪,将皮肤剪成 1 cm×1 cm 大小后置于细胞分选仪中,加入 2 mL 即用型高浓度 Tryple 消化 15 min。将消化得到的基底细胞悬液加入用 0. 5 mg/mL 纤维连接蛋白溶液以约 5 μg/cm2 包被的培养瓶中,于 37 ℃、含体积分数 5% 二氧化碳培养箱内静置 20 min。加入含青霉素、链霉素的 KC SFM 无血清培养基培养(培养基下同),200 倍倒置相差显微镜下观察培养 3、7 d 细胞状态。每 2~3 天换液 1 次,待细胞生长至70% 融合时,进行消化传代。采用流式细胞仪检测第 3 代细胞(浓度 5×106 个/mL)CD44、CD45 表面抗原标记(采用兔抗小鼠 CD44 多克隆抗体、兔抗小鼠CD45 单克隆抗体,稀释比均为 1∶200),当 CD44 百分比>90%,CD45 百分比<5% 时,提示培养的细胞为ESC。本鉴定实验重复 3 次。
另采用免疫荧光法鉴定种子细胞。将分离培养的第 3代裸鼠细胞消化、PBS 重新悬浮(细胞浓度为 1×105 个/mL),培养于玻底直径15 mm的玻底细胞培养皿。待细胞贴壁后,40 g/L 多聚甲醛室温固定 10 min,用含体积分数 10% 山羊血清的 PBS 室温封闭 1 h。分别同时滴加兔抗小鼠整合素 6α 单克隆一 抗 和 大 鼠 抗 小 鼠 p63 多 克 隆 一 抗(稀 释 比 均 为1∶100)或者兔抗小鼠整合素 6α 单克隆一抗和大鼠抗小鼠 CD71 多克隆一抗(稀释比均为 1∶100),4 ℃下 孵 育 过 夜 。 针 对 整 合 素 6α 加 入 Alexa Fluor488 标记的山羊抗兔 IgG 二抗,针对 p63 和 CD71 加入 Alexa Fluor 594 标记的山羊抗鼠 IgG 二抗(稀释比均为 1∶200),室温孵育 1 h。DAPI 共染,激光扫描共聚焦显微镜下观察 p63、整合素 6α 和 CD71 的定位及表达情况。细胞同时阳性表达 p63、整合素 6α,且阴性表达 CD71 则提示为 ESC。将对数生长期的第3 代裸鼠 ESC 用于后续实验。
1. 3 裸鼠分组与处理
取 4 只裸鼠,颈椎脱臼处死,取乙醇消毒后的背部全层皮肤,去除皮肤肌肉及脂肪,切成 1 cm×1 cm大小皮片,无菌生理盐水冲洗 3 次,将纱条于生理盐水中浸湿后包裹皮片,暂于 4 ℃保存。消化第3 代裸鼠 ESC,PBS 重新悬浮至细胞浓度为 1×105个/mL,暂于 4 ℃保存。另取 26 只裸鼠,采用随机数字表法平均分为 PBS 组和 ESC 组。以异氟烷麻醉裸鼠,调节空气泵使输出的气体流量为 300~500 mL/min,以体积分数为 3. 0%~4. 0% 的异氟烷诱导麻醉,维持体积分数为 1. 0%~1. 5%,直到手术结束。裸鼠背部乙醇消毒,在每只裸鼠背部切开制备 1 个 1 cm×1 cm大小全层皮肤缺损创面。伤后即刻,于 ESC 组裸鼠创面喷涂前述制备好的裸鼠 ESC 1 mL,于 PBS 组裸鼠创面喷涂 PBS 1 mL。将预制好的裸鼠皮片移植至创面(1 个创面移植 1 块皮片),边缘缝合,内层垫凡士林纱布,创可贴包裹,外层自粘绷带包扎。
1. 4 观测指标
1. 4. 1 大体情况和皮片存活与收缩情况 分别取 2 组 10 只裸鼠,于术后 0(即刻)、3、7、14、21 d 观察皮片大体情况,利用数码相机对皮片进行拍照,用 Image Pro 图像分析软件(美国 Media Cybernetics公司)进行分析,计算术后 3、7、14、21 d 皮片成活比和皮片收缩率。以血运良好,皮肤弹性及皮温可,无缺血坏死为植皮成活判定标准,皮片存活比=存活皮片数÷总皮片数。皮片收缩率(%)=(术后 0 d 皮片面积−术后各时间点皮片面积)÷术后 0 d 皮片面积×100%。
1. 4.2 皮片血流灌注情况术后 3、7、14 d,取1. 4. 1 行大体观察后裸鼠同前采用异氟烷进行麻醉,用激光散斑血流成像仪分别检测 2 组裸鼠皮片的血流灌注情况。裸鼠始终放置于 40 ℃恒温电热毯上并且尽量保证每只裸鼠检测时的麻醉时长一致,以减少温度变化和麻醉时间对测量血流灌注造成的偏差。检测完成后,采用成像仪附带软件包PIMSoft 获取、分析和报告血流灌注相对值。皮片的血流灌注情况直观观察:红色代表血流灌注多,黄色次之,蓝色代表血流灌注少。将 2 组 10 只裸鼠两两配对,计算术后 3、7、14 d ESC 组与 PBS 组裸鼠皮片血流灌注比 ,即 ESC 组裸鼠皮片血流灌注相对值÷PBS 组裸鼠皮片血流灌注相对值,只针对 2 组配对均存活的皮片进行计算。
1. 4. 3 炎症因子及胶原蛋白相关因子表达1. 4. 3. 1 mRNA 表 达采 用 实 时 荧 光 定 量RT-PCR 法检测。分别取 2 组剩余 3 只裸鼠,于术后7 d 同前采用异氟烷进行麻醉,取每只大鼠 0. 5 cm×0. 5 cm 大小皮片组织。取部分组织,常规提取样本总RNA、合成互补 DNA。引物由生工生物工程(上海)股 份 有 限 公 司 合 成,引 物 序 列 及 产 物 大 小 见表 1。 采 用 宝 生 物 染 料 法 荧 光 定 量 试 剂 盒 及Mx3000P 实 时 PCR 系 统( 美 国 CA 公 司 )检 测TNF-α、IL-8、IL-10、Ⅰ型胶原、Ⅲ型胶原、MMP-9、GAPDH 的 mRNA 表达情况。以GAPDH 为内参照,采用 Δ 循环阈值(Ct)法,即 2−ΔΔCt处理结果。本实验重复 3 次,结果取均值。

1. 4. 3. 2 蛋白表达 采用蛋白质印迹法检测。取 1. 4. 3. 1 剩余皮片组织,常规提取样本总蛋白、检测浓度。取 30 μg 蛋白质进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,湿法转膜,50 g/L 脱脂奶粉溶液室温下封闭 1 h。分别加入大鼠抗小鼠 IL-10 多克隆一 抗 、兔 抗 小 鼠 TNF- α 多 克 隆 一 抗 、兔 抗 小 鼠IL-8 单克隆一抗、兔抗小鼠 MMP-9 多克隆一抗、兔抗小鼠Ⅰ型胶原单克隆一抗、大鼠抗小鼠Ⅲ型胶原多克隆一抗、兔抗小鼠 GAPDH 单克隆一抗(稀释比均为 1∶1 000),4 ℃下孵育过夜。分别加入辣根过氧化物酶标记的山羊抗兔 IgG 二抗和辣根过氧化物酶标记的山羊抗鼠 IgG 二抗(稀释比 1∶5 000),室温下 孵 育 1 h。 化 学 发 光 检 测 免 疫 反 应 条 带 ,采 用Image J 图像分析软件(美国国立卫生研究院)行灰度 分 析 ,以 GAPDH 为 内 参 照 ,观 察 TNF- α、IL-8、IL-10、MMP-9、Ⅰ型胶原、Ⅲ型胶原蛋白表达。
1. 5 统计学处理
采用 SPSS 26. 0 统计软件进行数据分析,采用GraphPad Prism 8 制图软件绘图。计数资料数据以频数表示,采用 Kaplan-Merier 法描绘裸鼠皮片成活曲线并行组间 Log-rank 检验(软件自动略去该统计量值)。计量资料数据均符合正态分布,以 xˉ ± s 表示,对 2 组间单一时间点指标比较行独立样本 t 检验;对2 组间多个时间点总体比较行重复测量方差分 析 ,组间两两比较行独立样本 t 检 验 并 进 行Bonferroni 校正;单一指标多个时间点数据总体比较行单因素方差分析。P<0. 05 为差异有统计学意义。
2 结果
2. 1 ESC 生长状态及鉴定
从裸鼠皮肤分离的原代细胞培养 3 d,可见细胞已形成细胞克隆群,贴壁牢固;培养 7 d,细胞明显增殖加速,细胞连接成片状,呈铺路石状。见图 1。从裸鼠皮肤分离的第 3 代细胞,经流式细胞仪鉴定显示,CD44 的百分比为(96. 7±1. 4)%,CD45 的百分比为(0. 77±0. 05)%;经免疫荧光法鉴定可见培养 2 d,细胞阳性表达 p63 与整合素 6α,阴性表达 CD71,见图 2。综上,提取的裸鼠皮肤细胞为 ESC。
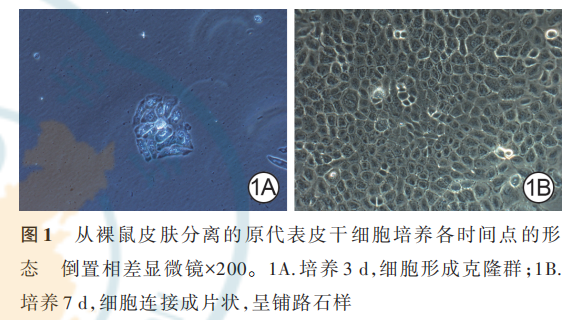
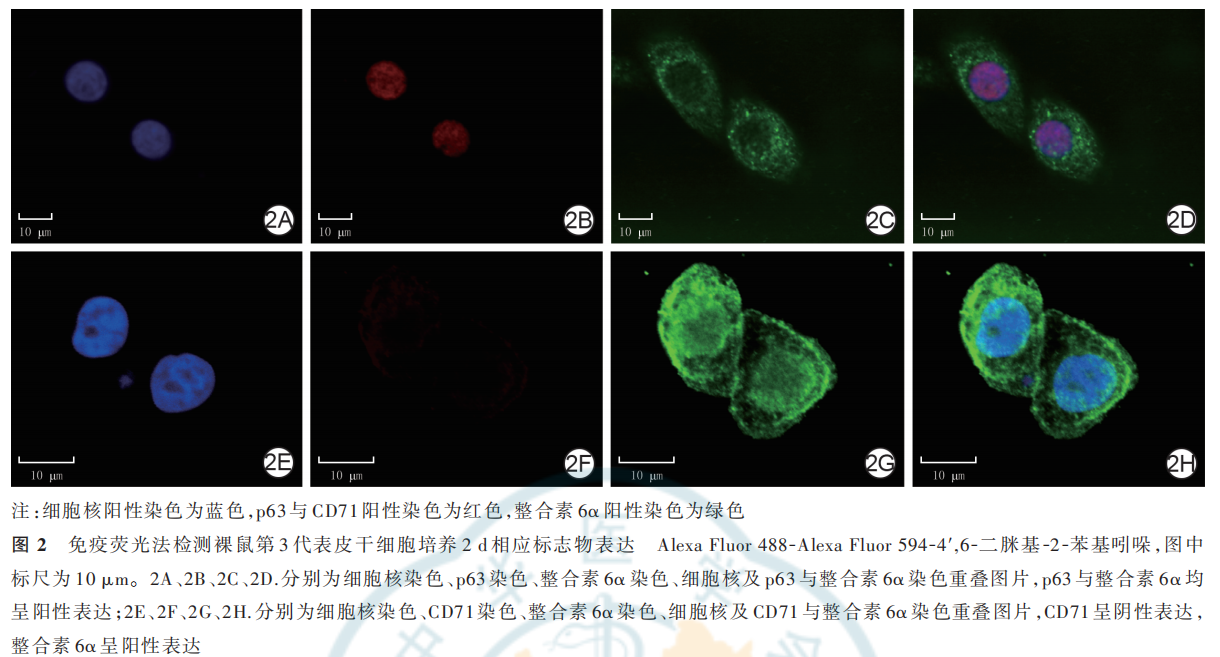
2.2 大体情况及皮片存活与收缩情况
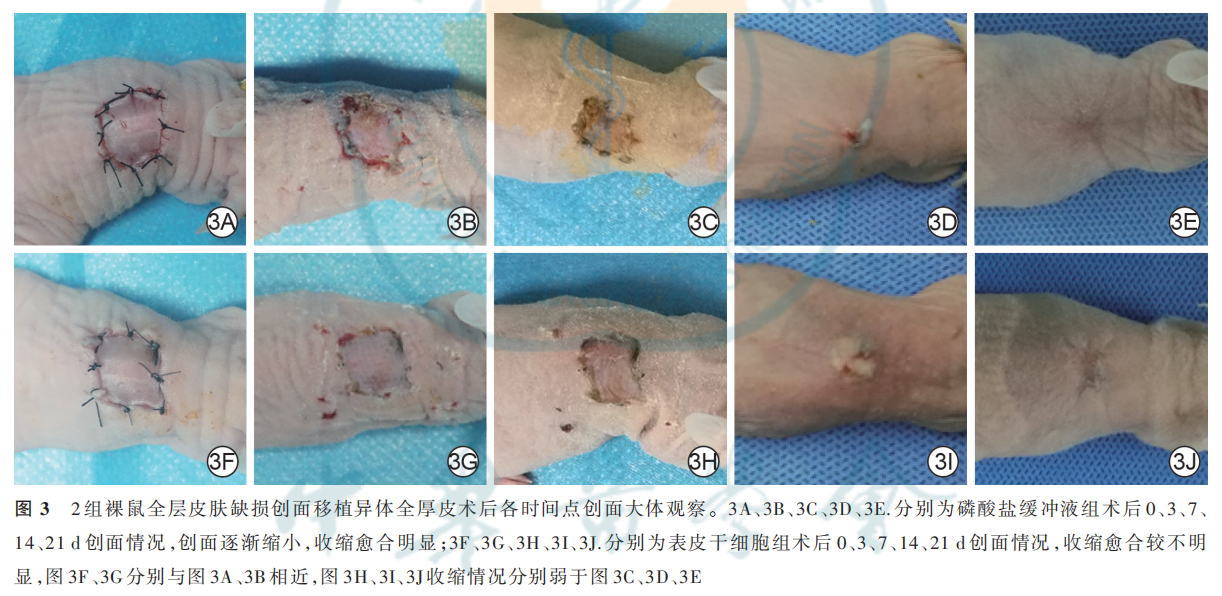
除去皮片未成活的裸鼠,以术后 0d 情况为参照,术后3 d,2 组裸鼠皮片均贴合良好,未见明显血肿及水疱,皮片均无明显收缩;术后 7 d,PBS 组裸鼠皮片出现较明显收缩,而 ESC 组裸鼠皮片收缩不明显;术后14 d,2 组裸鼠创面已基本愈合,见少量痂皮覆盖,皮片收缩均较之前更为明显,其中PBS 组裸鼠皮片收缩更明显;术后 21 d,2 组裸鼠创面完全愈合,皮片颜色与正常皮肤相近,PBS组裸鼠创面收缩愈合情况仍较ESC 组明显。见图3。
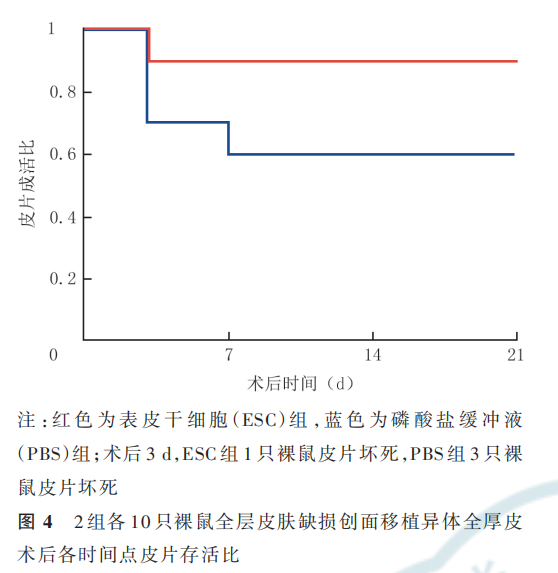
术后 3 d,ESC 组 1 只裸鼠皮片移植失败,PBS 组3 只裸鼠皮片移植失败。术后 7~21 d ESC 组裸鼠皮片存活良好;术后 7 d PBS 组又 1 只裸鼠皮片移植失败,术后鼠术后 14、21 d PBS 组裸鼠皮片存活良好。2 组裸3、7、14、21 d 皮片存活比总体比较,差异无统计学意义(P=0. 134),见图 4。术后 3、7、14、21d,PBS 组 裸 鼠 的 皮 片 收 缩 率 均 明 显 高 于ESC组(P<0.01),见表 2。
2.3 皮片血流灌注情况
术后 3、7、14 d,2 组裸鼠的皮片均显示出血流灌注信号,见图 5。术后 3、7、14 d,ESC 组与 PBS 组裸 鼠 皮 片 血 流 灌 注 比 分 别 为 1. 2±0. 4、1. 3±0. 4、1. 4±0. 5,均值均大于 1,3 个时间点总体比较,差异无统计学意义(F=0. 182,P=0. 836)。

2. 4 皮片组织炎症情况
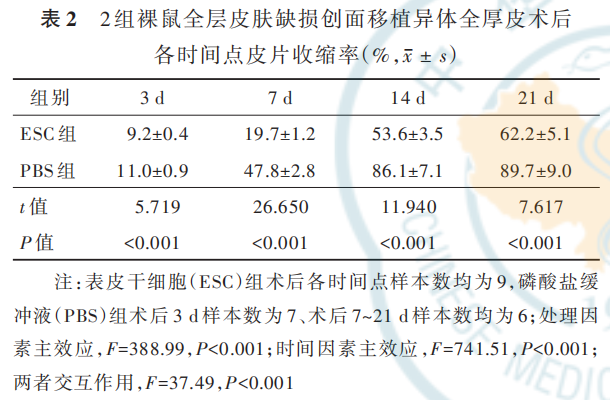
术 后 7 d,ESC 组 裸 鼠 皮 片 组 织 中 TNF- α 和IL-8 的 mRNA 表 达 量 分 别 为 0. 42±0. 18、0. 41±0. 18,明显低于 PBS 组的 1. 19±0. 34、1. 32±0. 40(t=2. 823、2. 934,P=0. 048、0. 043);IL-10 的 mRNA 表达 量 为 3. 13±0. 71,明 显 高 于 PBS 组 的 1. 03±0. 29(t=3. 877,P=0. 018)。术后 7 d,与 PBS 组比较,ESC 组裸鼠皮片组织中 TNF-α 和 IL-8 的蛋白表达均明显降低,IL-10 的蛋白表达明显升高,见图 6。
2. 5 皮片组织胶原蛋白相关因子表达情况
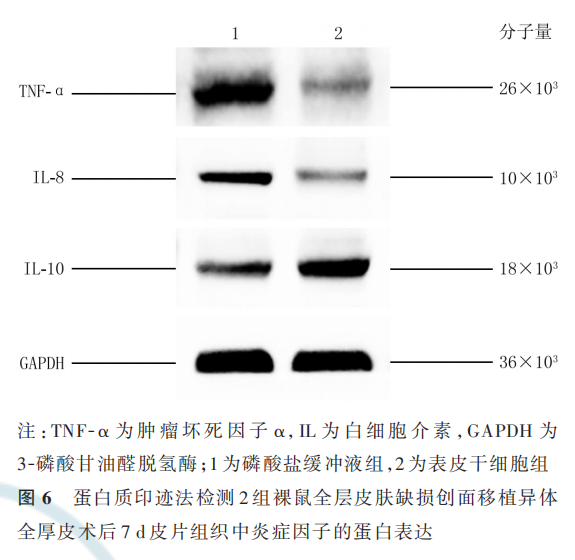
术后 7 d,ESC 组裸鼠皮片组织中Ⅰ型胶原和Ⅲ型 胶 原 的 mRNA 表 达 量 分 别 为 0. 73±0. 09、0. 75±0. 11,明显低于 PBS 组的 1. 15±0. 19、1. 09±0. 17(t=2. 845、2. 860,P=0. 047、0. 046);而 MMP-9 的 mRNA表 达 量 为 1. 44±0. 35,明 显 高 于 PBS 组 的 0. 88±0. 20(t=2. 916,P=0. 043)。术后 7 d,与 PBS 组比较,ESC 组裸鼠皮片组织中Ⅰ型胶原和Ⅲ型胶原的蛋白表 达 明 显 下 降 ,而 MMP-9 的 蛋 白 表 达 明 显 升 高 ,见图 7。
3 讨论
目前,越来越多的研究将干细胞用于创面治疗并取得了一定的成效[21-28]。ESC 作为皮肤组织特异性干细胞,与皮肤的修复有着密切关系。表皮基底细胞含有 1%~10% 的 ESC。有研究表明,自体基底细胞悬液可通过促进取皮区再上皮化从而促进创面愈合,在治疗慢性创面时,STSG 联合喷涂自体基底细胞悬液可提高皮片成活率和增加皮片愈合质量[29-33]。因此,进一步开展 ESC 对皮片愈合质量影响的研究具有应用前景。
本研究中,通过即用型高浓度 Tryple 快速消化及纤维连接蛋白吸附的方法分离提取并鉴定了裸鼠的 ESC。随后制作裸鼠背部全层皮肤缺损创面,予以全厚皮植皮治疗,ESC 组的裸鼠创面喷涂了约1×105 个 异 体 ESC。 对 比 皮 片 存 活 情 况 ,ESC 组 仅1 只裸鼠的皮片移植失败,而 PBS 组出现了 4 只裸鼠的皮片移植失败,但 2 组裸鼠各时间点皮片存活比总体比较,差异无统计学意义(P>0. 05),这可能与本研究样本量较小有关。根据大体图片对比 2 组裸鼠皮片收缩情况可见,从术后 7 d 起,ESC 组裸鼠的皮片收缩明显弱于 PBS 组,说明 ESC 能够提高皮片成活的质量,而其中的原因可能与创面床和移植皮片间血运的建立有关。因此本研究进行进一步的皮片血流灌注检测,结果提示,术后 3 d 起皮片移植成功的裸鼠植皮区均已出现新生血管,并且 ESC 组裸鼠皮片在术后 3、7、14 d 的血运情况好于 PBS 组。由此,本研究得出,ESC 提高移植皮片成活质量与促进创面床和移植皮片间新生血管的形成有关。进一步分析皮片组织炎症情况显示,相比 PBS 组,ESC组裸鼠术后 7 d 时促炎性细胞因子 TNF-α 和 IL-8 的mRNA 与蛋白表达均明显降低,而抗炎性细胞因子IL-10 的 mRNA 与蛋白表达明显升高,说明 ESC 在植皮成活过程中可降低炎症反应。在植皮区胶原蛋白的表达上,本研究显示 ESC 在术后 7 d 可降低胶原蛋白的形成,从而提高皮片移植后的愈合质量。此外,MMP-9 的上升可促进创面细胞的迁移,并且可水解变性胶原,调控 ECM 的动态平衡,有利于创面的愈合。本研究显示,相比 PBS 组,ESC 组裸鼠术后 7 d 时 MMP-9 的 mRNA 与蛋白表达水平均明显升高,说明 ESC 可通过提高 MMP-9 的表达提升皮片移植后的成活质量。
综上所述,本研究表明异体裸鼠的 ESC 可以通过促进创面床与移植皮片间血供的建立,降低炎症反应和胶原蛋白表达,促进 MMP-9 的表达,从而促进裸鼠全层皮肤缺损创面移植的异体全厚皮片成活后的质量。该结论为 ESC 促进移植皮片成活提供了一定的理论基础,为临床上治疗全层皮肤缺损创面提供了新的思路。
利益冲突 所有作者均声明不存在利益冲突
参考文献
[1] Akita S. Wound repair and regeneration: mechanisms, signaling [J].Int J Mol Sci,2019,20(24):6328.DOI:10.3390/ijms20246328.
[2] Werdin F,Tenenhaus M,Rennekampff HO.Chronic wound care[J].Lancet,2008,372(9653):1860-1862.DOI:10.1016/S0140-6736(08)61793-6.
[3] Sorg H,Tilkorn DJ,Hager S,et al.Skin wound healing: an updateon the current knowledge and concepts[J]. Eur Surg Res, 2017,58(1/2):81-94.DOI:10.1159/000454919.
[4] Kaplani K,Koutsi S,Armenis V,et al.Wound healing related agents: ongoing research and perspectives [J].Adv Drug Deliv Rev ,2018, 129:242 -253.DOI:10.1016/j.addr.2018.02.007.
[5] Andreassi A, Bilenchi R, Biagioli M, et al. Classification and pathophysiology of skin grafts [J]. Clin Dermatol, 2005, 23(4):332-337.DOI:10.1016/j.clindermatol .2004.07.024.
[6] Converse JM, Smahel J, Ballantyne DL Jr, et al. Inosculation of vessels of skin graft and host bed: a fortuitous encounter [J].Br J Plast Surg , 1975, 28(4): 274 -282 . DOI : 10.1016/0007-1226 (75) 90031 -4.
[7] Gkotsoulias E. Split thickness skin graft of the foot and ankle bolstered with negative pressure wound therapy in a diabetic population: the results of a retrospective review and review of the literature[J].Foot Ankle Spec,2020,13(5):383-391.DOI:10.1177/
[8] Boyce ST,Simpson PS,Rieman MT,et al.Randomized, paired-site comparison of autologous engineered skin substitutes and split-thickness skin graft for closure of extensive, full-thickness burns[J]. J Burn Care Res, 2017, 38(2): 61-70. DOI: 10.1097/ BCR.0000000000000401.
[9] Takabayashi Y ,Ishihara M,Kuwabara M, et al. Improved survival of full -thickness skin graft with low -molecular weight heparin-protamine micro/nanoparticles including platelet -rich plasma[J]. Ann Plast Surg, 2017, 78(5): 562-568. DOI: 10.1097/ SAP.0000000000001051.
[10] Nica O , Popa DG, Grecu AF, et al. Histological aspects of full -thickness skin grafts augmented with platelet -rich fibrin in rat model[J].Rom J Morphol Embryol,2019,60(2):581 -588.
[11] Behr B,Ko SH,Wong VW ,et al.Stem cells [J]. Plast Reconstr Surg,2010,126(4):1163-1171.DOI:10.1097/PRS.0b
[12] Kirana S, Stratmann B, Prante C, et al. Autologous stem cell therapy in the treatment of limb ischaemia induced chronic tissue ulcers of diabetic foot patients [J]. Int J Clin Pract, 2012, 66(4):384 -393.DOI:10.1111/j.1742-1241.2011.02886.x.
[13] Maranda EL, Rodriguez-Menocal L, Badiavas EV. Role of mesenchymal stem cells in dermal repair in burns and diabetic wounds[J]. Curr Stem Cell Res Ther, 2017, 12(1): 61-70. DOI: 10.2174/1574888x11666160714115926.
[14] Kølle SF, Fischer-Nielsen A , Mathiasen AB, et al. Enrichment of autologous fat grafts with ex -vivo expanded adipose tissue -derived stem cells for graft survival: a randomised placebo -controlled trial[J].Lancet,2013 ,382(9898):1113-1120.DOI:10.1016/S0140- 6736(13)61410 -5.
[15] Teng M, Huang YS , Zhang HS . Application of stems cells in wound healing --an update[J]. Wound Repair Regen, 2014, 22(2):151-160.DOI:10.1111/wrr.12152.
[16] Chen CY, Rao SS, Ren L, et al. Exosomal DMBT1 from humanurine-derived stem cells facilitates diabetic wound repair by promoting angiogenesis[J]. Theranostics, 2018, 8(6): 1607 -1623. DOI:10.7150/thno.22958.
[17] Li Z,Maitz P.Cell therapy for severe burn wound healing [J/OL]. Burns Trauma, 2018, 6: 13[2020-07-04]. http ://burnstrauma. biomedcentral. com/track/pdf/ 10.1186/s41038 -018 -0117-0. DOI:10.1186/s41038 -018-0117-0.
[18] Shawky LM, El Bana EA, Morsi AA. Stem cells and metformin synergistically promote healing in experimentally induced cutaneous wound injury in diabetic rats [J].Folia Histochem Cytobiol , 2019, 57(3):127 -138.DOI:10.5603/FHC.a2019.0014.
[19] Wang P,Hu ZC,Cao XL, et al.Fibronectin precoating wound bed enhances the therapeutic effects of autologous epidermal basal cell suspension for full-thickness wounds by improving epidermal stem cells' utilization[J].Stem Cell Res Ther,2019,10(1):154.DOI: 10.1186/s13287 -019 -1236 -7.
[20]Huang SB ,Hu ZC ,Wang P ,et al .Rat epidermal stem cells promote the angiogenesis of full -thickness wounds [J].Stem Cell Res Ther, 2020 ,11(1):344.DOI :10.1186/s13287-020-01844 -y.
[21]Harris JE,Dhupa S .Treatment of degloving injuries with autogenous full thickness mesh scrotal free grafts [J]. Vet Comp Orthop Traumatol, 2008 ,21(4):378-381.DOI:10.3415/vcot-07-04-0029.
[22]Zografou A,Tsigris C,Papadopoulos O,et al.Improvement of skin-graft survival after autologous transplantation of adipose-derived stem cells in rats [J].J Plast Reconstr Aesthet Surg , 2011, 64(12): 1647-1656.DOI:10.1016/j.bjps.2011.07.009.
[23] Xiao SE, Liu ZY,Yao YZ, et al.Diabetic human adipose-derived stem cells accelerate pressure ulcer healing by inducing angiogenesis and neurogenesis [J]. Stem Cells Dev, 2019, 28(5): 319 -328.DOI:10.1089/scd.2018.0245.
[24] Phinney DG,Pittenger MF .Concise review: MSC-derived exosomes for cell -free therapy [J]. Stem Cells , 2017 , 35(4): 851-858. DOI:10.1002/stem.2575.
[25] Lee DE, Ayoub N, Agrawal DK. Mesenchymal stem cells and cutaneous wound healing: novel methods to increase cell delivery and therapeutic efficacy [J].Stem Cell Res Ther ,2016,7: 37.DOI:10.1186/s13287 -016-0303-6.
[26] Rustad KC,Wong VW,Sorkin M,et al.Enhancement of mesenchymal stem cell angiogenic capacity and stemness by a biomimetic hydrogel scaffold[J].Biomaterials,2012,33(1):80-90.DOI:10.1016/ j.biomaterials.2011.09.041.
[27] Badiavas EV ,Falanga V .Treatment of chronic wounds with bone marrow -derived cells [J]. Arch Dermatol, 2003, 139(4): 510-516. DOI:10.1001/archderm.139.4.510.
[28] Zhuge Y,Regueiro MM, Tian RX, et al. The effect of estrogen on diabetic wound healing is mediated through increasing the function of various bone marrow -derived progenitor cells [J]. J Vasc Surg,2018,68(6S): S127-135.DOI:10.1016/j.jvs.2018.04. 069
[29] Mesa KR,Kawaguchi K,Cockburn K,et al.Homeostatic epidermal stem cell self-renewal is driven by local differentiation[J]. Cell Stem Cell,2018,23(5):677-686.e4.DOI:10.1016/j.stem.2018.09.005.
[30] D'Arcangelo D, Tinaburri L, Dellambra E. The role of p 16INK4a pathway in human epidermal stem cell self -renewal, aging and cancer[J]. Int J Mol Sci, 2017, 18(7): 1591. DOI: 10.3390/ijms18071591.
[31] Jackson CJ, Tønseth KA, Utheim TP. Cultured epidermal stem cells in regenerative medicine [J].Stem Cell Res Ther ,2017,8(1): 155.DOI:10.1186/s13287 -017- 0587-1.
[32] Hu Z,Guo D,Liu P, et al.Randomized clinical trial of autologous skin cell suspension for accelerating re -epithelialization of split -thickness donor sites[J]. Br J Surg, 2017, 104(7): 836 -842. DOI:10.1002/bjs.10508.
[33] Hu ZC, Chen D, Guo D, et al. Randomized clinical trial of autologous skin cell suspension combined with skin grafting for chronic wounds[J].Br J Surg,2015,102(2):e117-123.DOI:10.1002/ bjs.9688.
本文献包括图片转载于中华烧伤杂志 2021 年 11 月第 37 卷第 11 期,不代表本公众号赞同其观点和对其真实性负责,我们主要用于阅读分享,非商业用途,如若侵权,请告知删除。


