为解决皮肤缺损患者的移植物供体来源,在各种生物或合成材料上进行表皮细胞、成纤维细胞等的培养,构建皮肤替代物,是目前组织工程研究的热点。然而,既往组织工程皮肤存在的一个问题是其种子细胞来源为成熟或比较成熟的细胞,扩增次数、增殖能力有限,限制了它的应用。如何防止种子细胞的老化,是皮肤组织工程亟待解决的问题。表皮干细胞是原始的细胞,具有很大的增殖能力,是表皮发生、分化和创面修复的摇篮[1] 。本实验从鼠尾中提取胶原构建胶原海绵膜,用胶原Ⅳ快速黏附纯化、富集表皮干细胞,将传代的表皮干细胞和成纤维细胞种植于胶原海绵膜上,通过大体观察及组织学和免疫组织化学等方法观察创面愈合情况。
材料与方法
一、材料
1.人表皮干细胞的富集、培养与鉴定:将手术获得的幼儿包皮用0.25%胰蛋白酶与0.02%EDTA (1:1)消化(4℃,3~4 h ),使表皮和真皮分离。表皮置于200目网筛,用玻璃注射器针芯轻轻研磨,细胞悬液再与胶原Iv(美国Sigma公司)进行快速黏附10 min[2。4],去除黏附细胞,将黏附细胞按2×104个/cm2置于丝裂霉素C处理的3T3细胞滋养层进行培养。培养体系为:无钙低糖DMEM(Dulbecco’s minimal essential medium)培养基(美国Gibco公司),添加10%螯合钙的干细胞专用牛胎血清(fetal bovine serum,FBS,美国Hyclone公司)、表皮生长因子(epidermaI growth factor,EGF,美国Sigma公司)10”g/L、CaCl2 0.05 mmol/I。(美国Sigma公司)、氢化可的松0.8 mg/I。。5%CO。、饱和湿度、37℃孵箱内培养。以未进行黏附的角质形成细胞作为对照。倒置相差显微镜下观察细胞生长与形态变化情况,计算细胞传代数,流式细胞仪进行细胞周期分析,检测a bri CD7dim 细胞百分率[5、6],行K1 9(北京中山生物技术有限公司)免疫细胞化学染色[1](ABC法)。
2.人成纤维细胞的培养:真皮部分经胶原酶消化后,用含体积分数10%FBS(杭州四季青)的IM—DM(1scove’s modified Dulbecco’s medium)在5%CO2饱和湿度、37℃孵箱内培养。
3.胶原海绵膜的构建[7]:取大鼠鼠尾肌腱消毒、剪碎,用酸提取法提取胶原,将6一硫酸软骨素C溶液加入胶原溶液,于一30。C冰箱预冻4 h后,用真空冷冻干燥机进行冻干,然后置于真空高温行初步交联,再加入o.05%戊二醛进行第2次交联(4℃,24 h),真空干燥后即成为胶原海绵膜。
4.人工复合皮肤的构建[7]:胶原海绵膜经PBS (phasphate buffer solution)反复浸泡、冲洗,用75%乙醇消毒,再用1MI)M彻底冲洗;以1MDM预浸海绵膜24 h。取第2~3代成纤维细胞以l×106个/cm2的密度接种于胶原海绵膜上,培养体系为1MDM+10%FBS,在5%的CO。孵箱内37℃下培养4 d后翻转,在另一侧以2×105个/cm2的密度接种表皮干细胞,培养体系改为前面所述的干细胞培养体系。液面下培养3周,表皮干细胞融合后改为气一液界面培养12 d左右。以接种表皮细胞和未接种细胞的胶原海绵膜作为对照。构建后的复合皮肤用10%甲醛溶液固定,进行常规的脱水、包埋、切片,HE染色,光镜下观察。并将制备的人工皮肤行角蛋白免疫组化染色。
二、方法
1.动物移植实验口]:7~8周龄裸鼠90只(上海西普尔一必凯实验动物公司),随机分为3组。裸鼠用氯胺酮+地西泮(安定)麻醉后,于背部尾侧正中做1.5 cm×1.5 cm的全层皮肤缺损创面。实验组,移植含人表皮干细胞和成纤维细胞的复合皮肤替代物;对照组1,移植含人表皮细胞和成纤维细胞的复合皮肤替代物;对照组2,移植未接种细胞的胶原海绵膜。创口均用无菌纱布加压固定。
2.创而观察及组织学检查:术后每天观察伤口愈合情况。手术后7、1 4、21 d,每组各取6只动物处死,取创面组织检查(每处2块),1块固定于10%的中性甲醛后行HE染色,光镜下观察;另1块固定于2.5%的戊二醛中,常规超薄切片,透射电镜观察。
3.直接免疫荧光:抗体为鼠抗人HLA—I单克隆抗体,用荧光显微镜直接观察。
三、统计学处理
采用SPSS9.o软件进行方差分析及多重比较q检验。所有数据均表示为均值±标准差(π±s)。
结 果
一、表皮干细胞的生物学特性
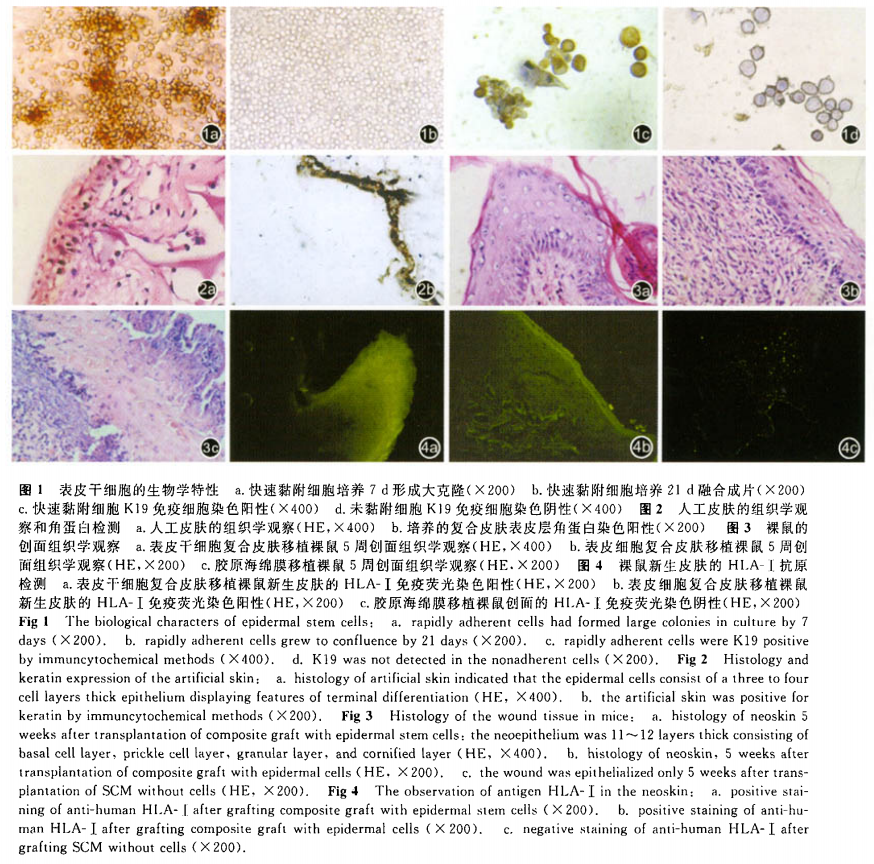
表皮干细胞于第3~4天可见多个集落出现,集落细胞增殖缓慢,第7~8天形成大克隆(图la),21 d融合成片(图1b)。大克隆形成后2~3 d可传代,克隆出更多的集落。共可传8~9代。而表皮细胞组几乎无大克隆出现,传代2~3次即不能生长。K19免疫细胞化学染色出现棕黄色,着色阳性表达的细胞为(47.27±4.88)%(图1c),对照组为(5.12±0.62)%(图1d),两组比较差异有统计学意义(P<o.05)。收集第3代表皮干细胞及不同分化阶段的角质形成细胞,上流式细胞仪(美国BD公司)检测,前者G。/G。期细胞百分率为(72.26±5.32)%,后者为(31.52±0.43)%,两者比较差异有统计学意义(P<0.05);加入a6一PE和CD71一F1TC单克隆抗体(美国BD公司),进行双色荧光标记,流式细胞仪检测a6 bri CD 7dim 细胞百分率,前者为(48.36±5.88)%,后者为(1.22±0.13)%,两组比较差异有统计‘学意义(P<0.05)。
二、复合皮肤的观察
气一液界面培养12 d后的人工皮肤,表皮干细胞组和表皮细胞组外观无明显差别。厚约0.4~0.6 cm,表面隐约有褐色表皮,表皮下为红色肉芽状物(于培养基中)。光镜下组织学观察可见体外培养的组织工程皮肤具有表皮层和真皮层,表皮层和真皮层结构清晰。其中表皮层可分为基底层、棘层、颗粒层和角质层,基底层细胞是骰状的,往上细胞逐渐变得扁平,最上层细胞脱核形成角化层;真皮层见胶原海绵膜网架逐渐被破坏,于近表皮侧基本消失,被大量的成纤维细胞及其所分泌的细胞外基质取代,完成了真皮重建(图2a)。培养的复合皮肤表皮层角蛋白染色阳性(图2b)。
术中情况:表皮干细胞复合皮肤质地柔软,可灵活剪切、拖移,且覆盖后人工皮肤与创面紧密粘贴,不易滑动。
术后大体观察:伤口包扎3 d后去除敷料,创面裸露。全部实验动物在术后均未发生感染,摄食、饮水、排便情况正常,均成活至完成实验。
术后第3天,实验组及对照组1移植的皮肤与创面贴合较紧,呈粉红色,对照组2贴合不如前两组,部分边缘翘起,创面有深红色的结痂。第7天,实验组及对照组1移植的皮肤与创面进一步融合,对照组2部分胶原海绵膜脱落。第2周,实验组创面基本愈合,对照组l有较多点片状裸露区,对照组2创面仍有深红色的结痂,但结痂区略缩小。第3周,实验组创面已愈合,对照组1基本愈合,但实验组创面愈合后较对照组更光滑,韧性及质地更佳,对照组l创面收缩明显,皮片凹陷。对照组2创面第5周瘢痕性愈合。
三、组织学观察
第1周活检,实验组HE染色示复合皮肤已成 活,表皮细胞3~5层开始分化。真皮内有较多的成纤维细胞及少量炎性细胞,可见新生毛细血管,大部分垂直于表皮生长。对照组l与实验组类似。第2周,实验组创面完全上皮化,新生上皮含6~8层细胞,并观察到基底层、棘层、颗粒层形成,角质层较薄。对照组1创面完全上皮化,新生上皮含3~5层。第3周,实验组出现钉突,对照组l未出现,对照组2在这过程中创面未愈。第5周,实验组较对照组1表皮更厚,实验组移植皮肤的形态结构与正常皮肤相似,对照组2见上皮化,但表皮细胞仅为1~2层(图3)。
免疫荧光染色检查:实验组及对照组1全部表皮层及部分真皮层抗人HlA—I型免疫荧光染色阳性,直接证明新生的皮肤为移植的人的细胞。对照组2为阴性(图4)。
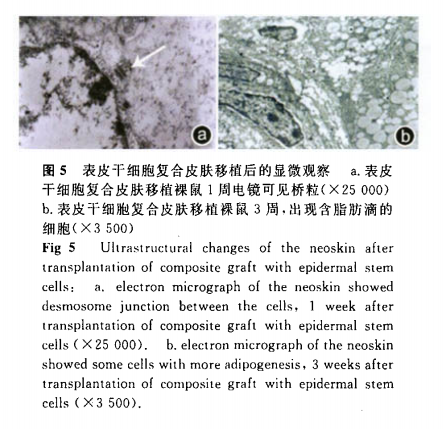
电镜观察:实验组第1周表皮细胞间桥粒清晰(图5a),对照组l未发现。实验组第3周表皮层出现6~7层细胞,且有核仁细胞较多,并于真皮层发现较多含脂肪滴的细胞(图5b),基底膜明显,且连续。’对照组l表皮层出现4~5层,有核仁细胞少,新生基底膜结构不清晰,真皮内胶原纤维排列疏松。对照组2创面未愈,未能取材行电镜检查。
讨论
自体皮源不足是治疗大面积烧伤等疾病的最棘手的难题之一。人们一直在寻求理想的皮肤替代物,利用组织工程和细胞培养技术研制的复合皮在近年来取得了长足的进步,一些产品已开始商品化,但距理想的人工皮肤尚有不少差距。比如,局部皮肤薄弱、抗拉及抗摩擦能力差等,无皮肤附属器,严重影响患者的生活质量,即使是培养的自体移植物亦然。推测其临床效果差的原因可能是移植的细胞为增殖、分化能力差的较老化细胞。如何缩短培养周期、防止细胞老化是亟待解决的问题。表皮干细胞是原始的细胞,抗原性弱,具有自我复制的能力,而且有多向分化的潜能,可能诱导分化出皮肤附属器,是皮肤组织工程理想的种子细胞[10-12]。
表皮干细胞通过表达a。J3。整合素,特异性的结合于基底膜IV胶原上。本实验利用干细胞与细胞外基质胶原Ⅳ紧密黏附的特性,纯化、富集表皮干细胞[3.13]。webb等[1 4]证明,表皮干细胞高表达黏附分子a6 (a6 bri),低表达与增殖相关的细胞表面标记 CD71(CD71dim),a6bri CD71dim 为干细胞;a6bri CD71bri为短暂扩增细胞;a。小1细胞为分化终末细胞。本研究中流式细胞术分析快速黏附细胞组a6bri CD71dim 近50%,明显高于对照组。K1 9是体内及体外表皮干细胞的标志[15]。快速黏附细胞体外培养呈克隆状生长,传代次数多,表现出更大的增殖潜能,K19的较特异表达,G。/G。期细胞65%左右,明显高于对照组,均符合干细胞的特征。
实验结果表明,表皮干细胞、成纤维细胞种植于胶原海绵膜上,可生成具有表皮层、真皮层的组织工程皮肤,具备了同正常皮肤类似的结构,表明其具有在体外分化成表皮的能力。表皮干细胞和表皮细胞购建的复合皮肤能有效覆盖裸鼠皮肤全层创面,没有出现移植物下积脓、出血及创周的组织反应,移植后皮肤各层生长良好,组织结构清楚,没有显示过度增生和肿瘤发生,均可作为皮肤缺损的移植物。表皮干细胞复合皮肤修复创面,其愈合时间、新生皮肤厚度、外观均优于用角质形成细胞购建的复合皮肤;电镜检查示有核仁细胞比例高,说明细胞增殖活跃。实验组第3周出现较多含脂肪滴的细胞,说明表皮干细胞有可能向脂肪细胞分化。本实验充分说明构建的表皮干细胞人工皮肤移植到受皮区,容易建立血液循环,并保持活力,达到覆盖创面、防止感染、防止体液流失的目的。其移植后外形比较丰满,质地、色泽、功能均优于表皮细胞复合皮肤。虽然其远期效果、抗原性、皮肤附属器的诱导分化等问题有待于进一步追踪观察和探讨,目前的初步研究已表明,它是一种有前途的组织工程皮肤。
参考文献


本文献包括图片转载于中华医学美学美容杂志2006年10月第12卷第5期,不代表本公众号赞同其观点和对其真实性负责,我们用于阅读分享,非商业用途,如若侵权,请告知删除。


