眼球的解剖特点决定了眼球位置暴露,组织结构脆弱,很小的外力, 异物或病变均可造成角膜损坏,最终导致失明【1】 ,传统角膜移植的供体主要来源于尸体和捐献,其来源非常有限,而且受到组织配型
的限制。
组织工程眼角膜技术的兴起为治疗可导致失明的眼角膜疾病带来了希望【2】 其基本方法是取少量自体健康角膜缘组织,体外培养扩增后种植于一种生物相容性良好的载体上! 形成结构与在体角膜相似的组织工程眼角膜移植到患侧眼表【3、4】虽然组织工程角膜不存在免疫排斥反应! 但对健眼造成了不必要的损伤" 现有研究表明,成体干细胞存在于许多成体组织器官中,具有多向分化及横向分化的能力,皮肤中的表皮干细胞已经成功应用于眼表损伤疾病的治疗并取得良好效果B。本研究利用自体表皮干细胞与异体角膜基质细胞复合角膜基质片在体外构建.双层组织工程角膜,并修复兔角膜缘干细胞的缺损。
材料和方法
材料新生及了月龄新西兰兔(第四军医大学实验动物中心提供,雌雄不限)、胎牛血清( Gibco)、FAD (DMEM:F12 为1:1) 培养液、DMEM (低糖型,Gibeo)、胰酶(Gibco)、角蛋白抗体(广谱型,Takara)、牛I型胶原(Gibco)、 免疫组织化学检测试剂盒(DAKO)。
自体表皮干细胞的培养取3月龄新西兰兔耳部皮肤组织,按照文献[4] 所述方法分离培养及鉴定表皮干细胞。原代细胞长满70%~80%时,用2.5g/L胰酶消化传代。
异体角膜基质细胞的培养取新生新西兰 兔的角膜组织,PBS 浸泡,清洗,用胶原酶消化获得单细胞悬液,过200目筛网去除杂质,离心收集细胞,用含10%胎牛血清的IMDM培养液重悬,以5x10%/ml的密度接种,6h后PBS冲洗去除未贴壁细胞。原代细胞长满70%~80%时,用2.5 g/L胰酶消化传代。
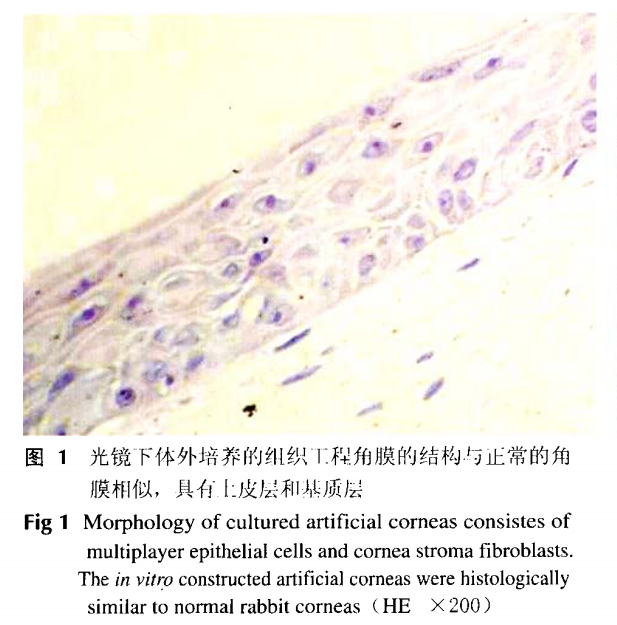
组织工程角膜的构建取生长状态良好的细胞,将培养的角膜基质成纤维细胞(密度为1x10/ml)与少量牛I型胶原(浓度1%)混合,接种到自制去细胞猪角膜基质片(方法参考文献[5])上,37°C孵育20nin,,凝固后加入DMEM培养液培养2周;在其表面以1x10/ml密度接种表皮干细胞继续培养3 d,将复合了细胞的支架移至气液面进行器官培养,继续培养2周,即获得组织工程人工角膜,冻存备用。取构建的组织工程角膜,4%多聚甲醛固定后,进行HE染色,观察其组织学形态。
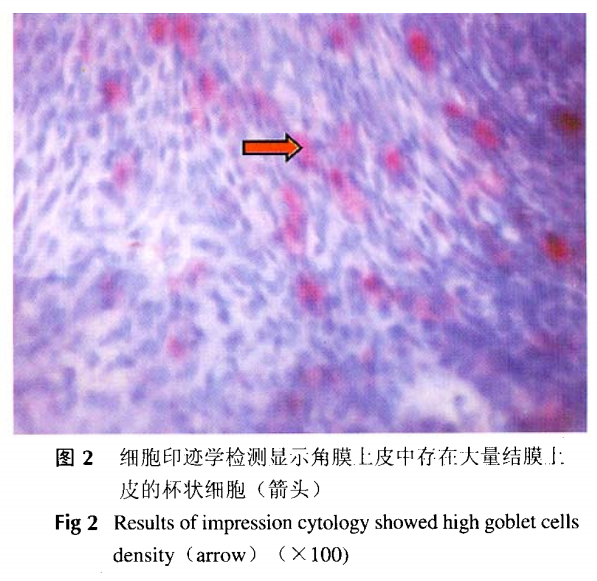
角膜缘干细胞动物模型的建立取3月龄新西兰兔,雌雄不限,体重1.5~2.0 kg,右眼均设为干细胞缺损模型眼;左眼为健康对照眼。利用麻醉药物素眠心(长春军需大学兽医研究所提供) 0.1~0.2 ml/kg 肌注麻醉。动物麻醉后,1%的利多卡因进行皮下麻醉,作上下直肌缝线固定,在手术显微镜下剪切角膜外缘3 mm的球结膜,暴露巩膜组织,以直径为11.5和8.5mm的环钻360°切削去除包括角膜缘外的1mm巩膜和角膜缘内2mm角膜组织的环行板层组织片,球结膜不缝合,平铺于角膜缘部。作直径8.0~8.5 mm的滤片纸浸润在1% NaOH后,放在角膜正中,1 min后去掉,用生理盐水冲洗。术毕,结膜下注射庆大霉素2万U。用庆大霉素眼液点眼,3次/日,金霉素眼膏0.2g涂眼,1次/晚。大体观察角膜水肿、混浊以及角膜新生血管情况。通过印迹细胞学观察杯状细胞数变化,了解角膜.上皮结膜化情况。
动物移植试验取经上述处理后有角膜白斑的新西兰兔,2%戊巴比妥钠腹腔注射30~ 50 mg/kg麻醉,解剖显微镜下用角膜板层刀剖切病变角膜。制备植床,剖切深度符合病变深度,基本上已达后弹力层。将人工角膜移入植床,用10-0尼龙线缝合。手术方法和术后护理与常规板层角膜移植手术相同。分别在术后1、3、6个月行活体观察及HE组织形态学检测。
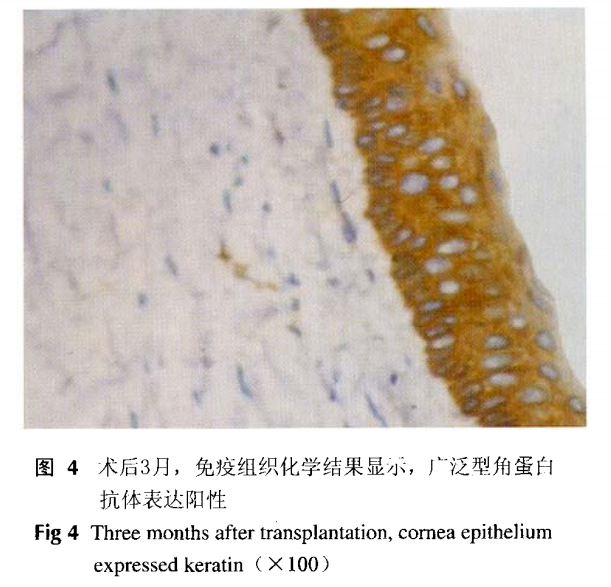
免疫组织化学染色用于鉴定皮肤上皮的广 泛型角蛋白抗体(Takara) 在正常角膜上皮阴性表达,本研究利用免疫组织化学方法,通过对广泛型角蛋白抗体(Takara) 检测来鉴定细胞来源。其具体方法为:切片常规脱蜡至水,3%H2O2, 37孵育10 min,以消除内源性过氧化物酶活性。磷酸缓冲液(PBS)洗涤后置于0.01 mol/L,pH 6.0的枸櫞酸盐缓冲液行抗原热修复后,以下过程按免疫组织化学检测试剂盒说明书进行。
结果
组织工程角膜大体观察构建的组织工程角膜为完整膜状、厚薄均匀、淡黄色、有光泽,与正常角膜相比透明度较差。光镜下可见体外培养的组织工程角膜结构与正常角膜相似,具有上皮层和基质层,未见细胞坏死或明显退变,无细胞异常增生。其中上皮层较薄,基质层较厚,二者结合处较为平整,结合紧密。上皮层不少于5~6层上皮细胞,排列整齐,无角化。基底层细胞多为矮柱状或立方状,胞核呈圆形或卵圆形,体积较小。在基底层的上方,由不少于4~5层体积较大的细胞组成,呈多边形,略扁平。基质层厚度约为上皮层的2~5倍,其中可见一定数量的生长状态良好的长梭形成纤维细胞,细胞轮廓和胞核清晰,与正常角膜相似(图1)。
角膜缘干细胞缺损模型可见角膜上皮有新生血管长入,角膜混浊,透明度下降,细胞印迹学检测可见角膜上皮内大量来自结膜上皮的杯状细胞(图2)。
移植后组织工程
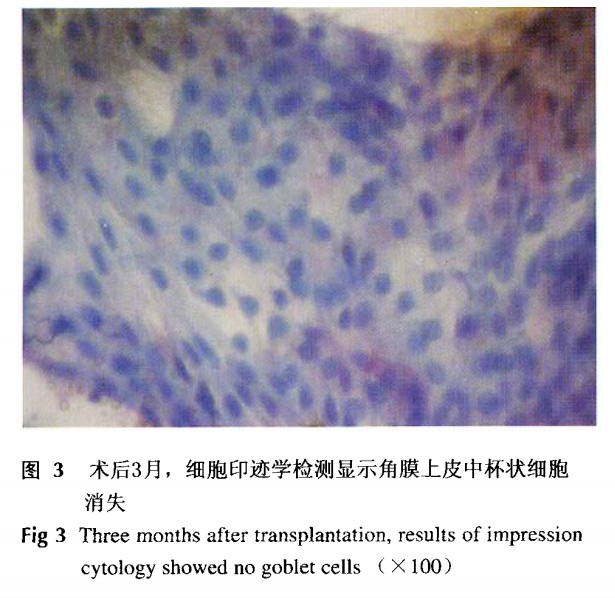
角膜术后1月,大体观察角膜透明度差,术眼均有结膜轻度充血;术后3月,大体观察角膜清晰度良好,组织学结构基本恢复正常;细胞印迹学检测杯状细胞消失(图3),术后6月,外观及组织学结构均恢复正常,无复发及感染出现。
移植后细胞来源鉴定免疫组织化学染色结果显示,移植后角膜上皮广泛型角蛋白表达阳性(图4),而对照组正常角膜上皮未见广泛型角蛋白的表达。
讨论
角膜病主要包括感染性角膜病、角膜变性和营养不良、角膜外伤(化学烧伤、热烧伤、角膜穿通伤等)和免疫性角膜病等,患病率较高1[6,7,是当今世界主要的致盲眼病之一。据世界卫生组织(WHO)统计,世界上有2 700~3 500万盲人,他们中多数可以通过角膜移植脱残脱盲。我国每年需要角膜移植治疗的患者超过10万,但仅有不到3000人得到移植,主要原因为可供移植的角膜来源严重受限。
组织工程眼角膜技术的兴起为治疗各种可导致失明的眼角膜疾病带来了希望8-11。理想的组织工程化人工角膜是以可降解材料为支架,在体外进行细胞培养,让细胞在材料表面及内部进行三维生长、分化成多层细胞,最后得到类似于供体角膜的含有活性细胞的组织工程眼角膜,并且可以有效修复各种原因导致的角膜损伤2131。但是传统组织工程眼角膜技术需要取自体健康角膜缘组织,组织来源有限,对健眼造成了不必要的损伤。成体干细胞存在于许多成体组织器官中,具有多向分化及横向分化的能力,在组织的修复和内环境的稳定上具有重要作用。有研究表明,皮肤中存在表皮干细胞,在一定条件下具有多向分化能力4,其中表皮干细胞与羊膜复合已经成功应用于眼表损伤疾病的治疗并取得良好效果15]。利用皮肤干细胞构建组织工程眼角膜用于修复角膜缺损,将解决困扰传统组织工程角膜技术的种子细胞问题,一旦获得成功,将具有极大的临床应用价值。
本研究以去细胞猪角膜基质片作为支架材料,以自体表皮干细胞与异体角膜基质细胞作为种子细胞,在体外构建组织工程角膜。结果表明,构建的组织工程角膜具有与正常眼角膜相似的组织学结构,虽然大体观察、组织工程角膜的透明度较差,但是最终成功修复了兔角膜缘干细胞缺损造成的眼表损伤,长期观察愈合效果良好。本研究建立的创伤模型以及组织工程角膜培养体系,为进一步构建人的组织工程角膜并将其应用于临床建立了实验基础。
参考文献
1. Nishida K. Tissue engineering of the cornea. Cornea, 2003,22(7 Suppl):S28-S34
2. Borene ML,Barocas VH, Hubel A. Mechanical and cellula changes during compaction of a collagen-sponge-based cornreal stromal equivalent. Ann Biomed Eng,2004, 32 (2):274-283
3. Nishida K, Yamato M, Hayashida Y, et al. Corneal recons-truction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med, 2004, 351 A (12):1187-1196
4. 董蕊,金岩,刘源.人表皮干细胞体外筛选及鉴定的实验研究.中国修复重建外科杂志,2003, 17(5): 351-354F
5. 张超,金岩,刘建明,等.异种脱细胞角膜基质材料的生物相容性研究.国际眼科杂志,2005, 5(2):250-252
6. Griffith M, Osbome R,Munger R, et al. Functional human corneal equivalents constructed from cell lines. Science,1999,286(5447):2169-2172
7. Duchesne B, Tahi H, Galand A. Use of human fibrin glue and amniotic membrane transplant in corneal perforation. Cornea, 2001 , 20(2):230-232
8. Kim JS, Kim JC, Na BK, et al. Amniotic membrane patching promotes healing and inhibits protei nase activity on wound healing following acute corneal alkali burn. Exp Eye Res,2000, 70(3):329-337
9. Heinz C, Eckstein A, Steuhl KP, et al. Amniotic membrane transplantation for reconstruction of comeal ulcer in graves ophthalmopathy. Cornea,2004, 23(5):524-526
10. Wilson S, Liu JJ, Mohan R. Stromal-epithelial interactions in the cornea. Prog Ret Eye Res,1999, 18(3):293-309
11. Friend J, Kinoshita S, Thoft RA, et al. Corneal epithelial cell cultures on stromal caurriers. Invest Ophthalmol Vis Sci, 1982,23(1):41-49
12. Ebato B, Friend J, Thoft RA.Comparison of central and peripheral human corneal epithelium in tissue culture. Invest Ophthalmol Vis Sci,1987, 28(9): 1450-1456
13. Nishimura T, Toda S, Matsumoto Y, et al. Effects of hepatocyte growth factor, transforming growth factor-beta1 and epidermal growth factor on bovine corneal epithelial cells under epithelial-keratocyte interaction in reconstruction culture. Exp Eye Res,1998, 66(1):105-116
14 Slack JM. Stem cells in epithelial tissues. Science, 2000,287(5457 ): 1431-1433
15 Brouard M, Barrandon Y. Controlling skin morphogenesis: hope and despair. Curr Opin Biotechnol, 2003, 14 (5): 520-525
本文包括图片转载于中国医学科学院学报,不代表本网站赞同其观点和对其真实性负责,我们用于阅读分享,非商业用途,如若侵权,请告知删除。


