正常的急性创面愈合是多种细胞、结构蛋白、生长因子及蛋白水解酶之间的复杂相互作用过程[1] 。如果过程中一种或多种参与调节的分子或生物学事件失调,将导致创面不按顺序愈合,形成慢性创面[1] 。皮肤慢性溃疡是最常见的慢性创面之一。皮肤慢性溃疡创面具有高水平氧化应激状态和菌群失调形成生物膜的特点[3] 。目前关于皮肤慢性溃疡的形成机制远未阐明,关于其研究成果用于临床治疗更是有限。造成上述主要原因之一是:研究所用的动物溃疡模型大多是急性切割伤口,其与临床上慢性溃疡形成过程不匹配。
皮肤感染性慢性溃疡的动物模型有全层皮肤切除模型和复合损伤溃疡模型[4] 。全层皮肤切除模型[5]造成的创面由于实验动物的自愈能力较强,与人体慢性皮肤溃疡情况不符;复合损伤溃疡模型是在全层皮肤切除模型的基础上叠加处理条件,向伤口注射金黄色葡萄球菌[6] 、铜绿假单胞杆菌[7] 等形成单一菌株定植感染,这种造模方法无法全面反映皮肤慢性溃疡多因素的发病机制和慢性炎症反应的特点;皮肤缺损后埋置异物通过影响局部血液循环从而使创面难以愈合[8] ,但造模难度较大并不是最优选择;利用糖尿病模型造成皮肤慢性溃疡也是常见的造模方法[9] ,但伤口愈合的复杂程度与临床实际存在较大差距,且高血糖实验动物致死率较高。因此,本研究根据慢性溃疡的病理特点,利用药物提高小鼠氧化应激水平,磁铁挤压皮肤模拟伤口组织缺血坏死,覆盖 3M 膜促进伤口腐肉形成和菌群失调,从而构建一种无需切割、可以自然形成的感染性皮肤慢性溃疡的动物模型,为皮肤慢性溃疡研究提供一种可选择的动物模型。
1. 材料和方法
1.1 实验动物
雄性 C57BL/6 小鼠(5-7 月龄,30g 左右)30 只购自南方医科大学实验动物中心(许可证号:SCXK(粤)2016-0041),开 放 环 境 适 应 性 饲 养 一 周 ,环 境 温 度(24±2)℃,相对湿度(50±10)%,12 h~12 h 光暗昼夜循环,每只小鼠单独置于塑料饲养笼内,可自由获取水和饲料。前期预实验模型雌性小鼠的耐受较差,致死率较高,所以采用雄性小鼠。
1.2 试剂和仪器
3-氨基-1,2,4-三唑(ATZ)购自梯希爱(上海)化成 工 业 发 展 有 限 公 司 。 巯 基 琥 珀 酸(MSA)购 自sigma。 Masson 三 色 染 色 试 剂 盒 购 自 迈 新 生 物 。iNOS、CD206 和 TNF-α 抗体购自 proteintech。兔二步法二抗试剂盒购自中杉金桥。DAB 显色试剂盒购自武汉博士德公司。圆形磁铁购自购自于深圳市飞鸿磁业有限公司,3M 透明敷料购自美国明尼苏达矿务及制造业公司,一次性使用采样器购自广州莱恩斯生物科技有限公司,石蜡包埋机、切片机、正置显微镜购自德国 Leica。
1.3 实验方法
1.3.1 感染性皮肤慢性溃疡的造模方法
C57BL/6小鼠连续 5 d 腹腔注射 ATZ(0.1 g/mL,溶于 PBS),剂量为每天 3 g/kg,之后用脱毛膏对小鼠背部进行脱毛处理;对称提起小鼠背部皮肤,使用两个直径为 12mm,厚度 5 mm,磁力 1000G 的圆形磁铁对小鼠背部皮肤进行挤压,12 h 后取下,12 h 后进行下一个循环,共 三 个 循 环 ,每 个 循 环 取 下 磁 铁 后 在 创 面 处 涂 抹MSA(0.1 g/mL,溶于蒸馏水),剂量为 300 mg/kg。3 个循环后,伤口部位贴无菌 3M 膜,之后一直保持 3M 膜覆盖伤口(图 1A 和 B)。
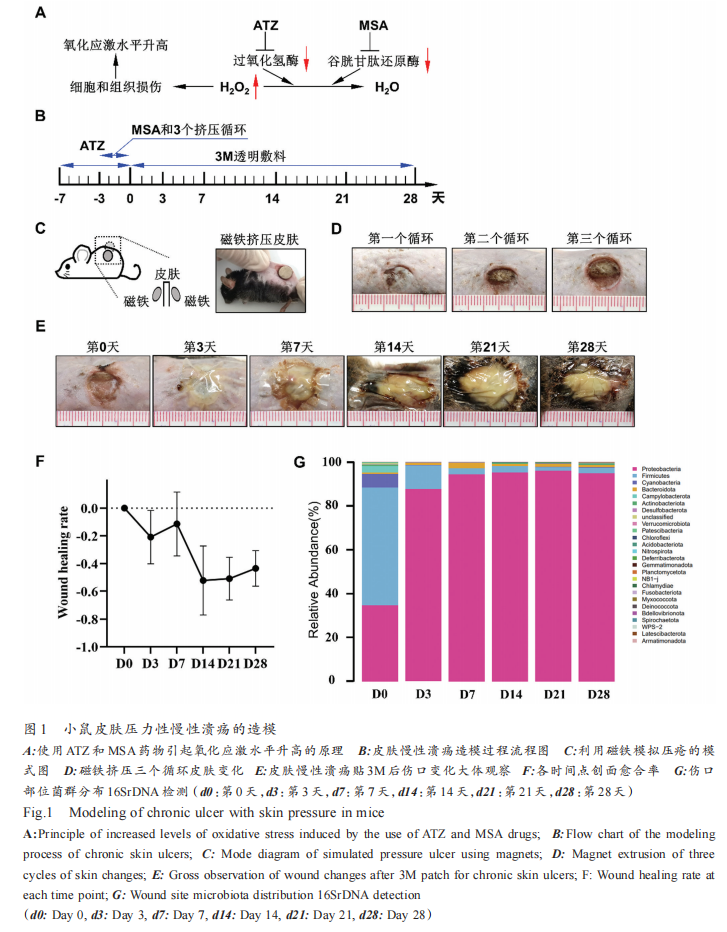
1.3.2 记录伤口愈合过程和样本采集 在小鼠伤口发展的第 3、7、14、21、28 d,大体拍照,对造模小鼠大体图伤口面积进行统计,计算创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积,之后将透明膜取下,用采样拭子在皮肤溃疡处采集渗出液用于菌群 16S rDNA 检测(杭州联川生物技术股份有限公司)。用 2% 戊巴比妥钠以 1.5 ml/kg 的剂量进行腹腔注射麻醉,将小鼠背部朝上进行固定,使用预冷的器材将伤口部位的皮肤剪下,迅速转移至预冷的 PBS中,将组织中的血液、皮下多余的组织去除,在滤纸上摊开皮肤,放入包埋框,转移至 4% 多聚甲醛中进行固定。
1.3.3 组织学常规检测 将在 4% 多聚甲醛中固定48 h 的皮肤组织流水冲洗 30 min,50% 酒精 2 h,70%酒精 8 h,80% 酒精 2 h,90% 酒精 1 h,95% 酒精 1h,100% 酒精Ⅰ 40 min,100% 酒精Ⅱ 40 min,二甲苯透明,包埋成蜡块后,5 μm 连续石蜡切片。石蜡切片 HE 染色:切片二甲苯脱蜡,梯度酒精复水,苏木精染液 15min,伊红染液染 1 min,梯度酒精脱水,二甲苯透明,中性树脂封片,通过正置显微镜拍摄图片。Masson染色:石蜡切片二甲苯脱蜡,梯度酒精复水,通过Masson 染色试剂盒进行染色,胶原纤维、黏液、软骨、神经纤维呈蓝色,肌肉、弹力纤维呈红色,红血球呈橘红色,通过正置显微镜拍摄图片。
1.3.4 免疫组织化学染色 石蜡切片二甲苯脱蜡,酒精梯度复水,0.1 mol/L 枸橼酸缓冲液(pH=6.0),95 ℃热修复 10 min,自然冷却后蒸馏水浸泡 5 min,重复 3次 ,3%H2O2 灭 活 内 源 性 过 氧 化 物 酶 ,PBS 冲 洗 ,含10% 山羊血清和 5%BSA 的封闭液封闭1h,4℃孵育一抗过夜 ,PBS 冲洗 ,室温孵育二 抗 1h,PBS 冲洗后DAB 显色,苏木素复染,流水冲洗,自来水返蓝,常规脱水、透明、封片。每组免疫组化结果选取高倍镜下5 个视野,iNOS 和 CD206 的免疫组化计算单位面积阳性细胞数占比;炎症因子 TNF-α 和 IL-1β 的免疫组化计算阳性单位面积平均光密度值,进行统计分析。
1.4 统计学分析
使用 GraphPad PRISM 9 软件进行统计分析。所有数据显示为平均值±标准偏差(SD),P<0.05 具有统计学意义。
2 结果
2.1 皮肤慢性溃疡的构建思路和形成过程
本实验连续 5 d 向小鼠腹腔注射 ATZ 抑制过氧化氢酶,之后利用两片磁铁挤压小鼠背部皮肤(图 1C),12 h 之后取下磁铁,在皮肤挤压部位涂抹 MSA 抑制谷胱甘肽氧化物酶,间隔 12 h 进行下一循环,共 3 个循环,逐步造成局部皮肤坏死,伤口边缘无血供,组织泛白(图 1D)。此时(即 d0),利用 3M 透明膜覆盖包裹伤口,封闭伤口与外界的空气流通,渗液渗出腐肉形成,使创面的微生物持续滋生,细菌定植形成生物膜,生物膜进一步加重伤口部位的炎症反应,导致皮肤形成慢性溃疡(图 1E)。
对造模小鼠大体图伤口面积进行统计,发现各时间点小鼠的创面愈合率均低于 0,即创面无愈合倾向,且在 d7 之后有加剧趋势,d14 后创面愈合率基本持平,慢性溃疡稳定,且至 d28 均无愈合倾向(图 1F)。在各时间点采集溃疡部位的渗液,进行 16S rDNA 检测,选取丰度 TOP30 物种分类,比较各时间点的优势菌种及其变化趋势,可见在 d0,细菌种类较多,变形菌门、厚壁菌门和蓝细菌门占大比例,而随着造模时间的延长,逐渐变成由变形杆菌门占主导地位,占比超过 95%(图 1G)。提示菌群失衡多样性减少,大量细菌繁殖分泌胞外聚合物形成黏液层-生物膜,生物膜的存在刺激进一步炎症反应,相辅相成使得创面迁延不愈。
2.2 小鼠皮肤慢性溃疡部位组织坏死,健康的肉芽组织难以形成
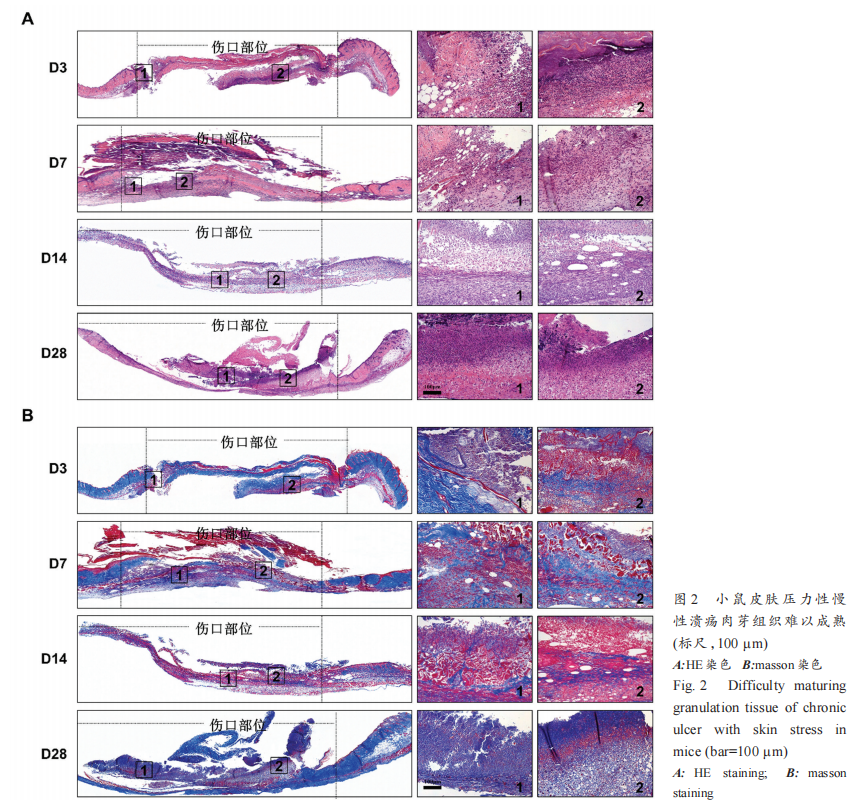
在d3、d7、d14、d28 对皮肤伤口进行取材,HE 染色结果显示,d3 伤口部位组织内开始有渗出物及炎症细胞浸润;d7、d14 可以发现伤口部位充满大量坏死的组织碎片,可见到细胞核浓缩、溶解和碎裂等情况,原组织轮廓消失,呈现一大片颗粒状物质 ;至d28,可见伤口周围的表皮进一步反应性增厚,但是未见爬行的上皮舌,伤口仍未有愈合倾向,伤口部位依然大量炎症细胞浸润,成熟的肉芽组织依然不能形成,导致伤口难以愈合(图 2A)。
进一步利用 Masson 三色染色,观察伤口部位细胞外基质的变化,结果显示,随伤口的发展,伤口部位的胶原纤维数量少,胶原纤维合成受阻,排列紊乱松散,红血球多,积聚有黏液样物质和坏死物,到 d28 仍无好转(图 2B)。
2.3 小鼠皮肤慢性溃疡部位 M1 和 M2 型巨噬细胞比例失调
通过 iNOS(诱导型一氧化氮合酶)标记 M1 型巨噬细胞,CD206(甘露糖受体)标记 M2 型巨噬细胞。结果显示:在造模的 d3 至 d28,伤口部位的 iNOS 阳性表达显著高于伤口周围正常皮肤,尤其在 d7,伤口部位 iNOS 表达量达到最高值,至 d28 伤口部位持续高表达 iNOS,伤口部位与正常皮肤部位表达差异具有统计学意义。而伤口部位的 CD206 表达量与伤口周围正常皮肤无明显差异。提示进入伤口的 M0 型巨噬细胞数量大部分转化为 M1 型巨噬细胞,M1 型巨噬细胞的表达量显著多于 M2 型巨噬细胞。将 M1 型和 M2 型巨噬细胞数量进行对比分析发现,整个伤口造模期间,M1 型巨噬细胞占比均高于 M2 型巨噬细胞,M1 型巨噬细胞比例增高将导致炎症持续,符合皮肤慢性溃疡中巨噬细胞的极化特征(图 3)。

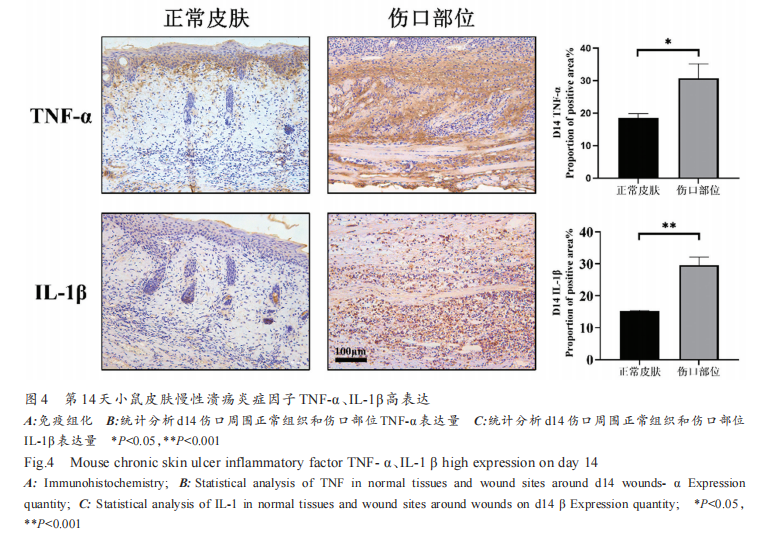
2.4 小鼠慢性溃疡皮肤高表达炎症因子TNF-α和IL-1β巨噬细胞通过分泌多种炎性介质和炎症因子增强机体的免疫应答,但过度的炎性因子释放会导致细胞损伤,加重炎症反应[10] 。M1 型巨噬细胞可以产生促炎细胞因子,如 TNF-α 和 IL-1β[11] 。通过免疫组化染色,可以发现 d14 的伤口部位高表达炎症因子 TNF-α 和 IL-1β,正常皮肤的表皮层及毛囊周围也有阳性表达(图 4)。与正常部位相比,TNF-α 表达具有显著差 异(P=0.0426,P<0.05);IL-1β 表 达 具 有 差 异(P=0.0092,P<0.05)。提示产生过量的炎症因子,使得炎症状态持续时间长,高水平的炎症因子刺激产生更高的炎症水平,延迟伤口愈合。
3 讨论
目前,皮肤慢性溃疡最常用的造模方法是建立在糖尿病模型动物的基础上[12] ,通过机体高血糖的环境来达到切割伤延迟愈合的目的,但高血糖动物需要实时监测和控制动物的血糖情况,容易出现死亡,且其伤口愈合的复杂程度与临床实际相比差距较大。皮肤慢性溃疡的主要特征是:溃疡中高水平的氧化应激状态,菌群失调以及慢性炎症状态。为尽可能的模拟皮肤慢性溃疡的形成过程,本研究一方面通过对正常小鼠进行造模,前期提高小鼠机体的过氧化氢水平,使其处于高氧化应激状态;正常小鼠皮肤中,过氧化氢酶和谷胱甘肽氧化物酶会将过氧化氢转化为水和氧气[13] ,所以正常的皮肤组织中过氧化氢水平不高。本研究通过利用 ATZ 抑制过氧化氢酶,使其失活[14] ;利用 MSA 抑制谷胱甘肽过氧化物酶,使其失活[15] 。这两种药物的使用使得小鼠皮肤内过氧化氢水平升高,进而引起蛋白质、脂质和 DNA 的氧化,细胞和组织的损伤,引发慢性炎症。另一方面,与传统的皮肤全层切除造成急性伤口相比,实验动物的切割伤愈合速度较快,而通过磁铁挤压造成的伤口,缺血再灌注的形式也更接近临床上大多数皮肤慢性溃疡形成的主要原因,有研究表明,采用磁铁挤压三个循环后即可得到 III 度压疮的创面[16] ,可以观察到皮下组织缺损和坏死的全层皮肤脱落[17] 。本研究使用“12 h 挤压-12 h 再灌注”三个循环的方法,可以看到小鼠皮肤全层逐渐缺血发白至坏死。
生物膜的形成是皮肤感染性慢性溃疡的重要特征。生物膜是由细菌及细菌在生长过程中分泌的胞外基质共同形成的一个复杂结构[18] ,生物膜的存在使得致病菌能够逃避宿主免疫监视和抵抗抗生素的作用[19] ,细菌外毒素的产生对机体持续造成损伤,导致伤口反复感染迁延不愈。部分研究制作皮肤慢性溃疡是通过切割伤后,在伤口部位注射菌群[20] 或直接移植生物膜[21] ,来模拟伤口感染的情况,但是菌群较为单一,如果采用的感染源污染性较大,则容易带来新的不确定性感染源;直接移植生物膜到实验动物的创面上,机体自身的状态与自身自然形成生物膜的实验动物还是存在很大的差异。本研究对小鼠皮肤造成创伤后,通过 3M 透明膜的包裹[22] ,使伤口与外界隔绝,不参与外界空气流通,不接受外界细菌植入,伤口渗液增加,为自身存在的细菌生长提供营养环境,加上机体高水平氧化应激状态,逐渐形成了生物膜。本研究利用 16SrDNA 对小鼠皮肤造模溃疡部位的细菌进行高通量测序[23] ,发现从第 3 天开始呈现出单一细菌门占大多数的趋势,第 7 天之后更是明显,提示此种造模方法可以因此伤口菌群的失调,而菌群的失调加剧了伤口部位的炎症反应,使伤口变成慢性,符合临床患者感染性慢性伤口的发展。
本研究进一步通过观察伤口形态学的变化和炎症水平,评价慢性溃疡的形成。研究发现至伤后 28d,大体观察伤口仍未愈合,透明膜覆盖部位仍有渗出和腐肉覆盖。HE 和 Masson 染色结果显示伤口部位大量炎症细胞持续浸润,胶原合成障碍、排列紊乱稀疏,积聚有黏液样物质和坏死物,符合临床上皮肤慢性溃疡伤口的形态学特征。巨噬细胞在炎症反应中发挥重要作用,M1 和 M2 不同的极化表型会导致炎症的不同表现[24] 。有研究表明,iNOS 主要由 M1 型巨噬细胞合成分泌,在皮肤组织中发挥作用产生高水平的一氧化氮参与机体炎症反应,可作为 M1 型巨噬细胞的标记物[25] 。而 M2 型巨噬细胞也已被证明高表达CD206,可作为 M2 型巨噬细胞标记物[26] 。免疫组化结果显示,伤口部位的 iNOS 表达显著高于正常组织,有研究结果也表明,Ⅲ度压疮创面组织的边缘及中心iNOS 的表达明显强于正常组织[27] 。在正常组织中,M1 型/M2 型巨噬细胞在炎症过程中比值增加[28] 。通过比较正常组织和伤口部位 iNOS 与 CD206 的比值,证明了创面处于持续的炎症状态,且过量产生炎症因子 TNF-α 和 IL-1β,符合慢性伤口中炎症反应的特征。
本研究通过药物处理、磁铁挤压、长期透明膜覆盖伤口的方式使得伤口难以愈合,建立了一个相对稳定自发感染性的皮肤慢性溃疡小鼠模型,其在临床表现、组织病理及病理生理方面都符合皮肤慢性溃疡的特征,此动物模型可为后续研究皮肤慢性溃疡的机制和药物筛选提供参考。
【参考文献】
[1] Clark RA, Ghosh K, Tonnesen MG. Tissue engineering for cutaneous wounds[J]. Invest Dermatol. 2007, 127(5): 1018-29. DOI: 10.1038/sj. jid.5700715.
[2] Chouhan D, Dey N, Bhardwaj N, et al. Emerging and innovative approaches for wound healing and skin regeneration: Current status and advances[J]. Biomaterials. 2019, 216: 119267. DOI: 10.1016/j. biomate rials. 2019.119267.
[3] Kim JH, Yang B, Tedesco A, et al. High Levels of Oxidative Stress and Skin Microbiome are Critical for Initiation and Development of Chronic Wounds in Diabetic Mice[J]. Scientific Reports. 2019, 9(1): 19318. DOI: 10.1038/s41598-019-55644-3.
[4] 徐凝, 吴闽枫, 段彦娟 . 慢性皮肤溃疡动物模型的研究进展[J]. 中国中医基础医学杂志 , 2020, 26(5): 704-707. DOI: CNKI: SUN:ZYJC.0.2020-05-047.
[5] 苑海刚, 薛凤, 赵钢. 蓬子菜水溶液对大鼠皮肤溃疡创面修复影响的实验研究[J]. 中医药学报 , 2016, 44(2): 40-42. DOI; CNKI: SUN:ZYXB.0.2016-02-015.
[6] 马忠丽, 张汉庆, 覃剑, 等 . 中药“敛疡散”对慢性皮肤溃疡的作用机制研究[J]. 中国中医骨伤科杂 志 , 2007, 15(4): 6. DOI: 10.3969/j.issn.1005-0205.2007.04.007.
[7] 王汉峰. 麦卢卡蜂蜜联合银离子敷料对铜绿假单胞菌感染创面及生物膜的影响 [D]. 兰州大学 , 2021. DOI: 10.27204/d. cnki.glzhu.2021.002901.
[8] 李媛, 赵光明, 董建勋, 等 . 中医病证相符的糖尿病慢性皮肤溃疡大鼠造模方法初探[J]. 中国实验动物学报, 2014,22(1):63-66+12. DOI:10.3969/j.issn.1005-4847.2014.01.012.
[9] Dhall S, Do DC, Garcia M, et al. Generating and reversing chronicwounds in diabetic mice by manipulating wound redox parameters[J].Journal of diabetes research. 2014, 2014: 562625. DOI: 10.1155/2014/
[10] Huang N Q, Jin H, Shi J S, et al. Research Progress of Resveratrol Inhibiting Microglial Activation in Neuroinflammation[J]. Chinese Pharmaceutical Journal, 2018, 53(2): 85-91. DOI: 10.11669/cpj. 2018.02.001.
[11] Rodrigues M, Kosaric N, Bonham CA, et al. Wound Healing: A Cellular Perspective[J]. Physiological Reviews. 2019, 99(1): 665-706. DOI: 10.1152/physrev.00067.2017.
[12] 刘燕芳, 毕新岭, 陈珏 . 糖尿病鼠皮肤伤口模型研究进展[J]. 解放军护理杂志 , 2017, 34(6): 45-47. DOI: 10.3969/j. issn. 1008-9993. 2017.06.011.
[13]Schäfer M, Werner S. Oxidative stress in normal and impaired wound repair[J]. Pharmacological research. 2008,58(2):165-71. DOI: 10.1016/ j.phrs.2008.06.004.
[14] Kim JH, Martins-Green M. Protocol to Create Chronic Wounds in Diabetic Mice[J]. Journal of Visualized Experiments. 2019,(151). DOI:10.3791/57656.
[15] Dunning S, Ur Rehman A, Tiebosch MH, et al. Glutathione and antioxidant enzymes serve complementary roles in protecting activated hepatic stellate cells against hydrogen peroxide-induced cell death[J]. Biochim Biophys Acta. 2013, 1832(12): 2027-34. DOI: 10.1016/j. bbadis.2013.07.008
[16] 叶祝君, 左丹, 张红侠, 等 . 人脐带间充质干细胞修复老龄啮齿类动物Ⅲ度压疮的效果研究[J]. 实用老年医学, 2018,32(5):430-432. DOI: CNKI:SUN:SYLA.0.2018-05-008.
[17] Stadler I, Zhang RY, Oskoui P, et al. Development of a simple, noninvasive, clinically relevant model of pressure ulcers in the mouse [J]. Journal of Investigative Surgery. 2004,17(4):221-7. DOI: 10.1080/
[18] Pegalajar-Jurado A, Easton C D, Crawford R J, et al. Fabrication of a platform to isolate the influences of surface nanotopography from chemistry on bacterial attachment and growth[J]. Biointerphases. 2015, 10(1):11002. DOI: 10.1116/1.4913377.
[19] Seth A K, Geringer M R, Hong S J, et al. In vivo modeling of biofilminfected wounds: A review[J]. Journal of Surgical Research. 2012,178 (1)330-338. DOI: 10.1016/j.jss.2012.06.048.
[20] 韩晓明, 罗宇慧, 施亚芳等. 慢性皮肤溃疡的疮疡模型治疗试验研究[J]. 中 国 医 学 创 新 , 2008, 5(36): 1-3. DOI: 10.3969/j. issn. 1674-4985.2008.36.001.
[21] Mendes AI, Peixoto MJ, Marques AP, et al. An optimized mouse model of Staphylococcus aureus infected diabetic ulcers[J]. BMC research notes. 2022,15(1):293. DOI: 10.1186/s13104-022-06170-5.
[22] 孔遐妮 . 3M 透明敷料对新生儿一次性电极片造成的接触性皮炎缓解效果[J]. 医学食疗与健康, 2022,20(4):58-60.
[23] Huang Y, Xiao Z, Cao Y, et al. Rapid microbiological diagnosis based on 16S rRNA gene sequencing: A comparison of bacterial composition in diabetic foot infections and contralateral intact skin[J]. Front Microbiol. 2022,13:1021955. DOI: 10.3389/fmicb.2022.1021955.
[24] 陈紫璐, 吴金结, 智伟, 等 . 藏药十八味党参丸提取物对脂多糖诱导的 RAW264.7 细胞 Akt/p38MAPK 信号通路及 M1/M2 极化影响的探究[J]. 中国药学杂志, 2022,57(01):38-43.
[25] Luca P, Elisabetta G, Denisa B, et al. Macrophage Polarization in Chronic Inflammatory Diseases: Killers or Builders? [J]. Journal of Immunology Research, 2018, 2018(12): 1-25. DOI: 10.1155/2018/
[26]Martinez F O, Helming L, Gordon S. Alternative activation of macrophages: an immunologic functional perspective[J]. Annual Review of Immunology, 2009, 27(1): 451-483. DOI: 10.1146/annurev. immunol.021908.132532.
[27]杨晔琴, 张纯瑜, 孙艳, 等. Ⅲ°压疮皮肤组织iNOS、P53和细胞凋亡的 变化[J]. 中国应用生理学杂志, 2011, 27(01): 50-51+61+133. DOI: 10.13459/j.cnki.cjap.2011.01.015.
[28] Fujisaka S, Usui I, Bukhari A, et al. Regulatory mechanisms for adipose tissue M1 and M2 macrophages in diet-induced obese mice. Diabetes. 2009,58(11):2574-82. DOI: 10.2337/db08-1475.
本文献包括图片转载于中国临床解剖学杂志 2023 年 第 41 卷 第 5 期,不代表本网站赞同其观点和对其真实性负责,我们主要用于阅读分享,非商业用途,如若侵权,请告知删除。


