

1 绪论
1.1 引言
挥发油是植物次生代谢产物,具有强烈的气味。挥发油因其独特的功能如杀菌、杀虫等,被广泛应用于医药、食品和化妆品领域。近年来,随着人们对产品安全意识的提高,消费者更信赖本土天然活性物质制成的产品。
哺乳动物的皮肤和皮毛的颜色取决于很多因素,最重要的因素是黑色素分布程度。酪氨酸酶是一种含有铜离子的多功能酶,是黑色素生物合成的关键酶[1]。因此酪氨酸酶抑制剂不仅能够作为皮肤美白剂用于化妆品中,还能作为皮肤色素沉着的治疗药物。虽然许多人工合成的酪氨酸酶抑制剂是很好的美白剂[2]。但其致癌作用[3]导致人们对研究开发天然产物制成的美白剂寄予厚望。
皮肤衰老与自由基的过量累积有着密切关系。紫外光的照射能够诱导皮肤产生大量的自由基,使人体自身的保护系统无法清除过多的自由基。而人们为了减少紫外光的照射,常常使用含有纳米二氧化钛等纳米物质的防晒剂,而这些纳米物质与人体皮肤表面的亚硝酸盐在紫外光的诱导下会产生活性氮[4]。活性自由基的存在与蛋白质氧化密切相关,而蛋白质的氧化总是伴随蛋白质酪氨酸硝化的发生而存在[5,6]
本章将对山苍子、丁香、香茅、酪氨酸酶的抑制、活性氧与皮肤的氧化损伤、紫外线、纳米二氧化钛与蛋白质的氧化损伤等方面进行简要综述。
1.2 山苍子、丁香、香茅
1.2.1 山苍子
山苍子(Litseacubeba)为我国特有的香料植物资源,属科木姜子属。中国山苍子油年产量达2000余吨,为世界上最大的生产和出口国。山苍子果实的挥发油含有 75% 的柠醛,叶子中的挥发油主要是1,8-桉油素[7]。
1.2.1.1 山苍子的药用价值
山苍子根、茎、叶和果实均可入药,在中医中被称为毕澄茄,并用于治疗胃寒打嗝、胃脘冷痛、寒疝腹痛、外伤出血、毒蛇咬伤、风湿关节痛等疾病,而山苍子果实被用来抗微生物和抗炎[8]。
1.2.1.2 山苍子的食用价值
山苍子果实油具有新鲜柠檬果香味,可直接用于糖果糕点、口香糖、冰淇淋、饮料、酱类调味品、调味油及焙烤食品等的调味增香[9]。最近有报道山苍子果实挥发油在化妆品或卷烟中的应用[10]。
1.2.1.3 山苍子的工业价值
山苍子果实油可以制成金属离子沉淀剂,用于沉淀污水中的重金属。同时,用山苍子果实油为原料生产的润滑油添加剂,在低温下不结冻,高温下能够保持润滑油的粘度不发生大的变化,因而在机械工业中得到广泛的应用。
1.2.1.4 山苍子的农业价值
山苍子油具有抗微生物抑制作用,对桔青霉、总状毛霉等多种霉菌均有较强的抑制作用。其主要成分柠檬醛可以让黄曲霉DNA链断裂,对蚕豆和玉米幼苗中常见的成虫都有较高杀灭作用[11]。此外,对茶树、棉花黄萎病和茶毛虫、红锈革病也有较强的防治作用。山苍子油对人体毒害作用小,对环境没有污染,而且香味宜人因此,山苍子油在防治储粮害虫、食品害虫、卫生害虫、杀菌防霉及防治作物病害等方面具有突出优点[12]。
1.2.2 丁香
丁香为桃金娘科植物丁香(Syzygium aromaticum(L.)Mer.&Perry)的干燥花蕾。丁香主产于我国广东省、印度尼西亚、马来西亚、坦桑尼亚等地。挥发油是丁香中的主要活性成分,其中主要成分为丁香酚,约占挥发油的75%~85%,其它成分还有乙酸丁香酯、甲基戊基甲酮、B-石竹烯等。丁香还含有黄酮、色原酮和三萜类成分[13]。丁香挥发油具有抑制肿瘤、抗氧化、止泻、镇痛、抗炎、抑菌等作用。丁香酚和丁香酚醋酸酯对胶原蛋白、肾上腺素和花生四烯酸所诱导的血小板聚集有强烈抑制作用,并呈剂量依赖关系[14]。丁香挥发油通常被用于顶级调味品和化妆品中具有抗蠕虫和健胃作用[15]。
1.2.2.1丁香油的抗微生物活性
丁香挥发油对微生物有较强的抑制作用[16]。丁香不同部位的提取物对空肠弯曲杆菌、沙门氏菌、大肠杆菌、金黄色葡萄球菌具有明显的杀灭作用[17.18]。赵晨曦等[19]研究丁香果挥发油和丁香花蕾挥发油的体外抗菌效果,实验结果表明,这两种挥发油对金黄色葡萄球菌和白色念珠菌十分敏感,对大肠杆菌和枯草杆菌也较敏感。唐裕芳等[20]用微波预处理-水蒸气同时蒸馏萃取法获得丁香花蕾油,并用该油对四种真菌和六种细菌进行抑制试验,结果显示,对金黄色葡萄球菌的最低抑制浓度为6.25mL/L,对蜡状芽孢杆菌、大肠杆菌、沙门氏菌和普通变形杆菌的最小抑制浓度为12.50mL/L,对枯草杆菌的最低抑制浓度为 25.00mL/L,对黑曲霉、青霉的最低抑制浓度为 6.25 mL/L,对黄曲霉、酵母菌的最低抑制浓度为12.50mL/L。最近有研究报告在15℃和5℃温度条件下,加入1%和2%的丁香油能够明显抑制利斯塔氏菌的繁殖[21]。研究发现丁香油能够对酿酒酵母菌细胞结构产生明显的破坏[22]丁香油能够抑制黑曲霉的生长[23]。丁香花蕾油对面包表面的真菌也有较强的抑制作用[24]。韩艳等[25]研究丁香挥发油和其主要成分丁香酚体外对幽门螺杆菌的活性,以氨苄西林为对照。结果氨苄西林对8种幽门螺杆菌菌株的最小抑制浓度为1.25~2.50μg/m,丁香挥发油的最小抑制浓度为5.00~10.00μg/mL,丁香酚的最小抑制浓度为 2.50~5.00 μg/mL。
1.2.2.2 抗病毒活性
Hussein 等[26]发现丁香萃取物对丙型肝炎病毒复制有很强的抑制作用。从丁香萃取物中分离出丁香酚对单纯疱疹病毒DNA 聚酶链的活性有强烈的抑制作用。
1.2.2.3 抗氧化活性
许多天然抗氧化剂为植物的多酚类物质,存在于植物果实、种子和叶子中[27]丁香油的主要成分为丁香酚,是抗氧化的主要成分[28]。抗氧化活性是通过不同的机制,如清除自由基和整合金属离子。Mihara and Shibamoto[29]研究发现丁香酚参与光化学反应,并表现出强烈的抗氧化活性和光细胞毒性[30]。Jirovetz等I发现十万分之五的丁香油在抗氧化活性方面等同于万分之一的丁酸酯苯甲醇。丁香花蕾油能够很好的整合铁离子,从而阻止羟自由基的形成[31]。丁香油作为天然抗氧剂广泛地被应用于制药行业中[32]。
1.2.2.4 抗癌活性
丁香花蕾油具有抗癌和抗诱变活性。最近研究表明丁香油对PC-3肿瘤细胞系和 HepG2 表现出细胞毒性[33],丁香酚表现出诱导癌细胞凋亡的特性。
1.2.2.5 麻醉活性
丁香酚的应用范围十分广泛,如在口腔科作为局部麻醉剂,在牙科中作为暂时填充剂粘固粉的成分[34]。相对于其他的局部麻醉剂,丁香酚的麻醉用量更低,并能够很快的代谢,没有消退期[35]。丁香酚对鱼的麻醉效果较好。
1.2.2.6 杀虫活性
用化学药物控制虫害面临诸多挑战,如环境危害和耐药性[36]。丁香酚对多种寄生虫有杀灭活性,如尖音库蚊、虱、大劣按蚊、螨虫和白蚁[37]
1.2.3 香茅
香茅属于禾本科香茅属(Cymbopogon)植物,是一种重要的草本香料,我国主产于广东、台湾、海南、福建、广西、四川、贵州、云南等省。香茅油广泛用于配制香皂、香精、香水、牙膏等日用品,甚至有研究人员将其添加到烟草中增加香气、改善香烟吸味、减少刺激性[38]。在亚洲许多国家,香茅是常用的驱蚊剂,并对许多农业害虫有胃毒、拒食、忌避活性[39]。
香茅挥发油的主要成分为香茅醛,但因具体品种的不同,挥发油的成分也会有明显差异。
纪淑娟等[40]以链格孢菌、炭疽菌、灰霉菌、蒂腐菌、串珠镰刀菌为供试菌株采用带药介质法研究了香茅挥发油对果蔬采摘以后主要致病真菌的抑菌活性。结果表明,香茅油对受试的致病菌均具有不同程度的抑制作用,其中,灰霉菌对香茅油最为敏感,浓度为300μL/L香茅油可以完全抑制灰霉病菌菌丝的扩增,蒂腐菌次之;当香茅挥发油的浓度为500μL/L时,可以完全抑制链格孢菌、炭疽菌、串珠镰刀菌菌丝的扩增。战广琴等[41]研究香茅油的主要成分香茅醛对黑曲霉的抑菌活性,结果香茅醛能够明显抑制黑曲霉的活性,主要表现在破坏细胞壁、质膜,改变质膜选择通透性,从而抑制菌丝体生长及孢子的萌发而引起细胞死亡。
Specos等[42]将香茅油用复凝聚法进行微胶囊化,然后将其添加到棉花纺织物中,将含有微胶囊化的香茅油的棉制纺织物与直接喷洒乙醇稀释的香茅油的棉制纺织物相对比三周,结果前者的驱虫效果和持久性方面明显好于后者。Günter等[43]研究香茅油、香叶醇、芳樟醇的驱虫效果,结果发现香叶醇无论是室内还是在室外,驱蚊效果都明显好于香茅油和芳樟醇。
1.3 酪氨酸酶的抑制
1.3.1 酪氨酸酶在黑色素生成中的重要作用
人类皮肤的颜色来源于皮肤的最外层,黑素细胞位于表皮并能够产生黑色素皮肤受到紫外线的照射后,黑色素形成的关键酶酪氨酸酶的活性增加,从而黑色素的形成也会增加。黑色素是由黑素小体生成。黑色素的两种类型真黑素和褐黑素(图1.1)均由黑色素小体合成[44]。
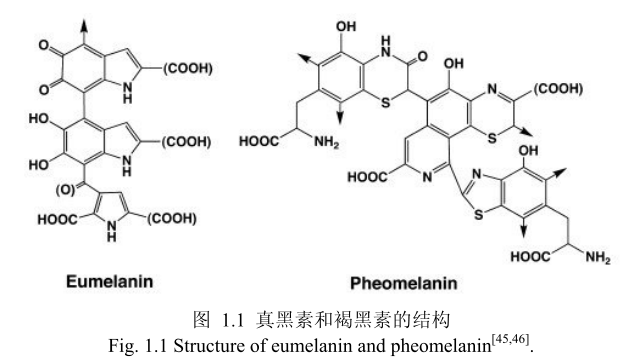
黑色素自身在皮肤的氧化平衡中起着重要作用。真黑素具有清除和淬灭氧和碳衍生的自由基的能力[47]。而褐黑素却没有这样的特性,甚至在紫外光照射后成为自由基形成的源头。
真黑素和褐黑素的合成路径如下(图1.2)。从图1.2可看出,酪氨酸酶在黑色素的合成中起着重要的作用。因为酪氨酸酶催化黑色素形成的前两步:L-酪氨酸羟化形成 L-二羟苯丙氨酸 (L-DOPA)和后续的联苯酚氧化为配 (-多巴醌) [48.49]。
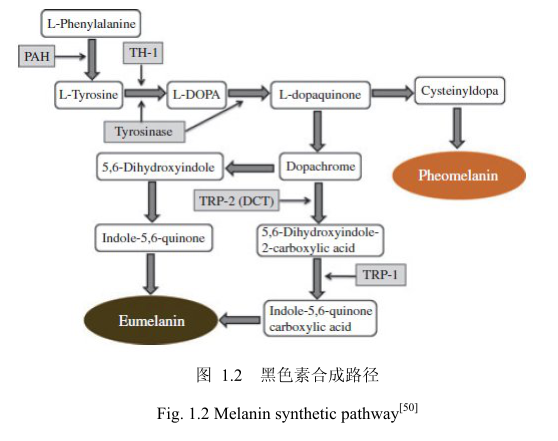
在形成多巴醌以后,黑色素合成路径分为两个方向,合成真黑素和合成褐黑素[51]。在真黑素路径中,多巴色素自发的转化成5,6-二羟吲哚或者在多巴色素互变异构酶(DCT)作用下转化成5.6-二羟哚-2-羧酸,同时涉及到酪氨酸相关蛋白2(TRP-2)。最后,哚和醌的聚合形成真黑素[52]。
1.3.2 常见的酪氨酸酶抑制剂
1.3.2.1 植物多酚类
植物多酚类天然抑制剂常常涉及包含多酚结构的化合物[53]。这些化合物常常为高等植物的次生代谢产物,具有多种生物活性。黄酮类物质是植物多酚类物质中研究最多的。这类化合物能够保护植物不被紫外线照射、病原体、食草动物所损害[54]一些黄酮类物质如山奈酚、槲皮素、桑黄素表现出对酪氨酸酶的抑制活性[55.56]。
许多研究关注天然来源的黄酮类酪氨酸酶抑制剂的抑制活性与结构的关系[56.57]。结果发现黄酮类物质含有的a-酮基表现出酪氨酸酶活性[57]。这种抑制能力可以用L-DOPA 的二羟苯基和黄酮类化合物的α-酮基的相似性来解释。一些黄酮拥有3-羟基-4-酮结构,如山奈酚和皮素,竞争性抑制酪氨酸酶活性因为其活性位点能够螯合铜,导致酪氨酸酶不可逆的失活[56]。与山奈酚和皮素相反,3 位氧连接糖苷的衍生物在高浓度下也并没有表现出抑制活性[55.56]。这表明C-3位的游离的羟基是具备活性的重要因素。但是,尽管羟基与活性有一定的关系,但是在很多黄酮中并不是必须的,例如木犀草素和木犀草素7位氧苷,并没有这种3羟基基团,却表现出酪氨酸酶抑制活性[57]。来源于木菠萝属和其它植物的芪类和相关的 4位取代的间苯二酚,表现较强的酪氨酸酶抑制活性[58]。从茶叶中能分离出不同的没食子酸衍生物[56,59]。其中部分具有较强的酪氨酸酶抑制活性,表明黄烷-3-醇骨架3位有没食子酰基是具有酪氨酸酶抑制活性的重要结构。
1.3.2.2 高等植物中的醛类和其它化合物
高等植物中分离出来的醛类和其它化合物如肉桂醛,2-羟基-4-甲氧苯甲茴香醛、枯茗醛和枯茗酸具有酪氨酸酶抑制剂的特征[60.61]。醛基能够与生物学上重要的基团如巯基、氨基、羟基发生反应。它们对酪氨酸酶的抑制机制推测可能是与酪氨酸酶上的主要氨基反应形成席夫碱[1]。有趣的是,在苯甲醛对位添加一个给电子基团能够提高抑制酪氨酸酶活性的能力,可能是稳定了席夫碱的结构。例如茴香醛和枯茗醛的抑制活性分别是苯甲醛的2.5倍和16倍。除了稳定结合位点之外,疏水给电子基团如甲氧基和异丙基对酶的亲和力与抑制活性可能有关。与芳香醛相似,脂肪醛、a,β-不饱和醛与酪氨酸酶主要的氨基形成席夫碱,而不是与双核铜活性位点结合[60.61]。而对应的饱和醛类并没有显示出明显的抑制活性。因为他们与酶之间的疏水作用导致其扰乱了酶的三级结构[62]
1.3.2.3 真菌代谢产物作为酶抑制剂
除了高等植物,一些来源于真菌的化合物也同样被鉴定出具有酪氨酸酶抑制活性[63]。曲酸是真菌的代谢产物[64],是过渡金属离子的优良整合剂和好的自由基清除剂1[65,66]。曲酸通过与活性位点的铜整合,达到抑制多种曲霉菌属和菇的酪氨酸酶活性[67]。黑曲霉菌中的金属硫蛋白对蘑菇酪氨酸酶有较强的抑制能力[68]。
1.3.2.4 天然化合物的衍生物
最近研究发现,一些天然化合物经过修饰后具有较强的酪氨酸酶抑制活性[69.70]没食子酸是单宁类物质酸水解或碱水解的产物,可以被用来生产没食子酸烷基酯类物质,如:没食子酸甲酯,没食子酸丙酯,没食子酸十二酯。在这些没食子酸衍生产物中,短链的烷基没食子酸酯如没食子酸甲酯和没食子酸辛酯能够被酪氨酸酶氧化产生淡黄色的氧化产物[69,70]。但是长链的没食子酸酯如没食子酸十二烷基酯能够抑制酶的活性而不产生有颜色的物质。
1.3.2.5 合成的抑制剂
许多酪氨酸酶抑制剂来源于药物或单一的化学物质,如卡托普利、托酚酮、羟胺类物质。卡托普利[(2S)-N-(3-mercapto-2-methylpropionyl)-L-proline]是一种广泛用作治疗高血压和心衰竭的药物[72]。这种药物对蘑菇酪氨酸酶表现出不可逆的非竟争性抑制[73]。卡托普利是一种铜螯合剂[74]。因此,卡托普利是通过与酪氨酸酶活性位点的铜离子整合来表现其抑制活性。此外,在抑制过程中,酪氨酸酶活性位点的半胱氨酸富集区和卡托普利之间发生二硫互换。
青霉胺与甲巯咪唑都具有酪氨酸酶活性抑制作用[75]。甲巯咪唑是通过两种方式来抑制酪氨酸酶活性:一是与醌结合从而抑制黑色素的合成;而另一种方式是与酶活性位点的铜结合。
在目前报道的抑制剂中,托酚酮(2-羟基-2.4,6-环庚三烯)是酪氨酸酶抑制能力最强的抑制剂之一[76]。尽管间苯二酚的酪氨酸酶活性抑制效果较差,但当间苯二酚的4位被疏水基团取代时,能够获得较高的抑制活性[77]。
过氧化氢是多种含铜酶类的灭活剂,将酪氨酸酶暴露在高浓度的过氧化氢中会失去酪氨酸酶和多酚酶的活性。酪氨酸酶的灭活速率与过氧化氢的浓度有关,并且在无氧的环境下快于有氧环境。
1.4 活性氧与皮肤的氧化损伤
1.4.1 皮肤中活性氧的产生
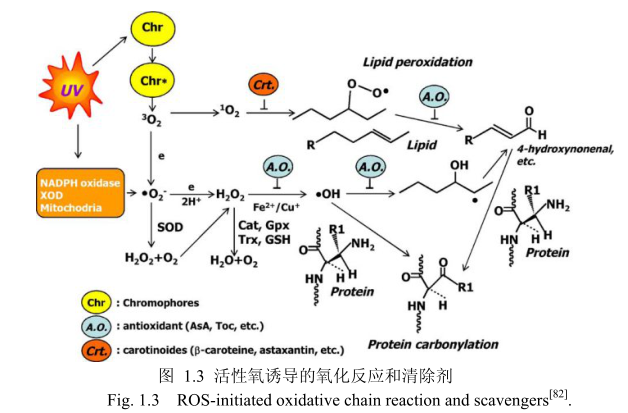
紫外光照射是皮肤中产生自由基的引发剂。但是,紫外光的波长决定自由基产生的类型。UVB通过激活NADPH化酶和呼吸链反应产生超氧阴离子(·02)[78,79],而UVA 通过与内部的生色团如核黄素和卟啉发生光敏反应生成单线态的氧。UVA也可以通过NADPH化酶的激活和糖化产物的光敏作用产生超氧阴离子。皮肤表面产生的活性氧的主要类型为单线态的氧,是通过与UVA和来源于生长在皮肤表面的细菌群落中的卟啉类物质的光敏反应产生[80,81]。单线态的氧反应后变成角鲨烯、胆固醇,在脂肪中生成过氧化氢脂质。
1.4.2 活性氧对生物分子的氧化
活性氧(ROS)可以分为两类:分子含有未成对的电子和分子处于高能态前一种包括超氧阴离子(·0)、羟自由基(·OH)、脂质过氧自由氢基(LOO·)和一氧化氮自由基(NO·);后一种是单线态氧(O)。脂质和蛋白质的氧化途径如下(图1.3)。超氧阴离子最先产生,并自发转化成过氧化氢或参与超氧化物歧化酶引起的代谢。过氧化氢更加稳定并且能够穿透细胞膜,通过Fenton反应在二价铁离子和一价铜离子存在的情况下产生羟自由基。羟自由基和单线态的氧氧化脂质不饱和键产生脂质过氧化和醛类,如4-羟基壬烯醛。羟自由基和产生的醛与蛋白质氨基酸残基反应生成羰基蛋白质。
1.4.3 活性氧对皮肤的影响
1.4.3.1 活性氧诱导炎症形成
UVB 辐射能够诱导皮肤红斑,俗称晒斑。活性氧,包括一氧化,诱导皮肤红斑加剧,刺激炎症过程[83]。
1.4.3.2 活性氧促使皮肤表面的氧化
氧化的脂类和蛋白质引起皮肤环境的改变。皮肤氧化应激形成角鲨烯,扰乱皮肤屏障功能,诱导皮肤粗糙[84]。烷基醛类进一步氧化过氧化氢脂质和蛋白质,在角质层产生羰基化蛋白。在冬季紫外线照射后羰基化蛋白的量增加[85]。除此之外,与正常的皮肤比较,有特异性皮炎的病人有更多的羰基化蛋白[86]。羰基化蛋白的水平反应了环境因素诱导的氧化应激的程度。因此,活性氧引起的氧化应激改变了皮肤的环境。
活性氧促进黑素生成1.4.3.3
活性氧对黑素细胞有异相作用,一方面活性氧可以去除色素,另一方面也可以增加皮肤黑素沉着。活性氧可以去除色素最典型例子如白癜风[87]。白癜风病人活性氧清除系统的不平衡导致皮肤中过氧化氢的聚集[88]。过氧化氢能够穿透细胞膜并目很容易从角蛋白细胞转移到黑素细胞,诱导黑素细胞衰退。过氧化氢的转移被认为是白癜风病形成的一个原因。活性氧能够加速皮肤黑素沉着已被证实。来自于角蛋白细胞中的一氧化氮自由基(NO·)通过增加酪氨酸酶和酪氨酸酶相关蛋白1来诱导黑素生成[89]。
1.4.3.4 活性氧诱导皮肤基质改变
活性氧对紫外光诱导的皮肤衰老过程(产生皱纹)有确定的作用。一般而言,皱纹产生是由于改变了皮肤基质(胶原断裂加速和胶原合成减少)。UVA导致的单线态的氧的产生,通过分泌白介素-1a和自介素-6刺激成纤维细胞中金属蛋白酶的表达[90]。而金属蛋白酶类会破坏已有胶原蛋白的结构,减弱新胶原蛋白的合成从而导致皱纹的形成。
1.4.4 皮肤的氧化损伤与衰老
氧化损伤来源分为内源和外源。内源性的损伤主要受遗传控制。外源性的氧化损伤主要由环境因素引起,如阳光、吸烟和其它污染,不平衡的饮食、缺乏运动、压力和疾病[91]。氧是自由基产生的关键因素,是皮肤衰老的标志。
正常情况下,人体内存在大量的抗氧化剂,如过氧化物酶、超氧化物歧化酶(SOD)、β-胡萝卜素、维生素E、维生素C等,它们能够清除体内过多的自由基,使人体内自由基的生成和清除处于动态平衡中。当人在紧张、忧愁、激烈运动、疾病状态时,或者在过度饮酒、吸烟等不健康的生活习惯等因素的影响下,或者由于环境污染、放射线照射、紫外线照射等因素作用时,都会引起自由基过量产生。如果此时人体内的抗氧化物不足,无法清除过多的自由基,就会导致人体健康受损[92],皮肤是人体最大的器官,随着年龄的不断增长,特别是暴露于外的皮肤,因为含有大量皮脂,并不断与氧气接触,加上经常遭受紫外线照射等因素,所以是最容易蒙受包括活性氧、过氧化脂质等化学物质的影响。自由基可以和皮肤的生物分子反应,引起脂质过氧化损伤,造成皮肤的损伤、衰老和色素过度沉积[93]。在皮肤中,活性氧引起的损伤导致黑素细胞产生过多的黑素小体、减弱弹性蛋白和胶原蛋白。这些变化会导致新的皮肤细胞更新的减慢。这些影响的积累就会导致皮肤起皱纹、脆弱、暗淡、色素沉着和黑斑。氧化损伤还可能会引起DNA突变从而导致角蛋白细胞在某些情况下癌变。
活性氧在导致皮肤衰老的过程中,能够扮演白细胞的功能来清除细菌和其它外源性物质。在这个过程中,能够在细胞内和细胞外形成少量的自由基。人体能够激发产生酶和抗氧化剂来限制自由基引起的损伤。在强烈的氧化应激时,人体的天然抗氧化剂不足以控制这些自由基和过度损伤的发生。口服和局部涂抹抗氧化剂能够增加人体天然抗氧化剂的供应,但并不意味着完全消灭自由基的产生。而是扩大人体的天然屏障,阻止过度损伤。
1.5 紫外线、纳米二氧化钛与蛋白质的氧化损伤
1.5.1紫外光照射对皮肤的损伤
皮肤衰老是一个复杂的生物学现象,包括两方面因素:一是内源性自然衰老;另一个是受环境因素影响的外源性衰老,其中紫外线的影响尤其重要,被称之为光老化。光老化是紫外辐照诱导的损伤和内源性损伤的叠加,在皮肤上表现出老化相关的变化,如表皮厚度改变、皮肤弹性组织变性、胶原减少、促进基质降解的金属蛋白酶类的增加、炎症浸润和血管扩张。
1.5.2 紫外线对蛋白质的氧化
体外研究表明 UVA 主要导致皮肤中的蛋白质氧化。细胞中氧化的蛋白质不断聚集,会抑制和损伤蛋白酶的功能[94]。同时,脂褐素的积累,即一种高度交联修饰的蛋白质的积累,会进一步抑制蛋白酶的功能。
1.5.3 纳米二氧化钛对皮肤的损伤
随着人们对防晒重要性的认识日趋深入,人们对防晒护肤品的要求也越来越高,因此防晒产品的需求增长迅猛,各种防晒剂不断涌现。纳米二氧化钛比普通二氧化钛粒径更小、活性更大,因而具有更好的吸收紫外线的能力,同时其对皮肤不会有刺激和过敏现象,这些都决定了纳米二氧化钛是化妆品中应用最广泛的无机原料[95]。目前纳米二氧化钛已不仅用于防晒膏霜和乳液中,还广泛应用于口红、指甲油、粉底霜、粉饼和一些发用化妆品中。
纳米二氧化钛能穿透皮肤进入皮下组织的研究已有相关报道。Lademann等[96]。采用光谱分析法在皮肤的毛囊角质层检测到少量的纳米二氧化钛,占化妆品涂抹总量的 1%,但在表皮深层未检测到。Menzel等[97]利用猪的背部皮肤研究了纳米氧化钛的渗透性,发现涂抹8小时后,纳米二氧化钛穿过了皮肤的角质层进入到表皮下的颗粒层,并且利用扫描显微镜和二次电子成像技术观察到纳米二氧化钛通过皮肤细胞间的间隙进入皮下颗粒层而非通过毛囊孔。薛承斌[98]通过乳猪30天透皮实验发现,纳米二氧化钛能够透过乳猪皮肤的角质层进入到皮肤深层并对皮肤产生一定程度的损伤。通过裸鼠背部皮肤60天暴露实验发现,纳米二氧化钛可以跨越皮肤屏障,产生器官积蓄,导致暴露部位皮肤及重要的靶器官氧化应激损伤,使之MDA含量升高,SOD活性降低,进而导致皮肤中HYP含量降低,真皮内胶原蛋白含量减少,皮肤老化。
1.5.4 纳米二氧化钛对蛋白质的氧化硝化损伤
纳米二氧化钛通常被认为是没有毒性的[99]。但是最近又有研究表明,纳米二氧化钛对人并非完全没有害处[100]。许多研究表明,防晒霜中的成分如纳米二氧化钛能够促进水环境中微粒表面光催化形成活性氧(超氧阴离子和羟自由基)[101,102],即使是在低剂量和没有紫外光照射的情况下[103]。另外,在正常的光照条件下,汗水的蒸发会提高皮肤表面亚硝酸盐的含量[104]。由于紫外光的照射和皮肤表面存在的亚硝酸盐,二氧化钛光催化亚硝酸盐形成活性氨,如二氧化氨自由基和过氧亚硝酸盐阴离子[105],它们能够单独或者协同诱导脂质过氧化,氧化甲硫氨酸和半胱氨酸残基,引起蛋白质酪氨酸硝化,降低抗氧化活性和损伤 [106]。
蛋白质氧化和蛋白质酪氨酸硝化是蛋白质的氧化/硝化修饰,改变蛋白质的结构和功能。蛋白质硝化是指蛋白质中酪氨酸残基被硝化成3-硝基酪氨酸(3-Nitro-Tyrosine,3-NT),即在酪氨酸残基的羟基邻位上加一个硝基(-NOz)(图1.4)[107],是机体在氮氧化物存在的条件下氧化损伤的一种特殊形式。在病理状态下:伴随着活性氧和活性氮的增加,蛋白质硝化容易产生。目前的科学研究表明,蛋白质酪氨酸硝化是一种重要的蛋白质翻译后修饰,并与炎症、神经退行性疾病和心血管疾病等多种病症相关,其产物3-硝基酪氨酸作为O、ONOO:等活性氮的衍生物,被认为是许多生理和病理状态下的生物标志物[5,108-110]。
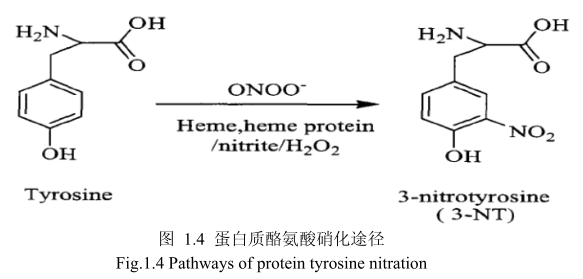
总之,蛋白质氧化和酪氨酸硝化很可能存在于纳米二氧化钛对皮肤的毒性作用中。
1.6 本文研究目的与内容
1.6.1 研究目的
人们对天然的抗氧化剂尤其是来源于本土植物中的挥发油在化妆品中的应用有着浓厚的兴趣。山苍子油、香茅油、丁香花蕾油来源于药用植物,长期作为香精的原料添加到化妆品中,在中国南方作为民间药方治疗皮肤疾病。本文的目的是评估它们在皮肤护理方面的潜在价值。研究结果为科学评判其能否成为美白护肤成分提供依据。
1.6.2 研究内容
(1)采用水蒸气蒸馏法提取山苍子油、香茅油、丁香花蕾油,采用单因素实验进行工艺优化,用GC、GC-MS分析三种挥发油的成分和含量。
(2)通过体外酪酸酶抑制试验,测定山苍子油、香茅油、丁香花蕾油及其主要成分对酪氨酸酶的抑制活性,并测定具有抑制酪氨酸酶活性的成分对酪氨酸酶的抑制类型。
(3)通过体外试验测定山苍子油、香茅油、丁香花蕾油及其主要成分对ABTS 和超氧阴离子的清除能力;对脂质过氧化的抑制能力。
(4)测定山苍子油、香茅油、丁香花蕾油及其主要成分对 UV-TiO2,-NO2催化的蛋白质氧化和硝化抑制作用。
1.7 参考文献
[1]Maeda K, Fukuda M, In vitro effectiveness of several whitening cosmetic components in human melanocytes. Journal of The Society of Cosmetic Chemists,1991,42(6):361-368
[2]Alena F, Jimbow K, Ito S. Melano cytotoxicity and antimelanoma effects of phenolic amine compounds in miceinvivo. Cancer Research, 1990.50(12):3743-3747
[3]Fujimoto N, Watanabe H, Nakatani T Induction of thyroid tum our sin(C57BL/6NxC3H/N)F, mice by oral administration of kojic acid. Food and Chemical Toxicology,1998,36(8):697-703
[4]Vione D, Maurino V, Minero C, et al. Phenol photo nitration upon UV irradiation of nitrite in aqueous solution ll: effects of pH and TiO2. Chemosphere, 2001.45(6-7):903-910
[5]Gow AJ, Farkouh CR, Munson DA, et al. Biological significance of nitric oxide-mediated protein modifications. American Journal of Physiology-Lung Cellular and Molecular Physiology, 2004,287(2):262-268
[6]Pacher P, Beckman JS, Liaudet L. Nitric oxide and peroxynitrite in health anddisease.Physiological Reviews, 2007,87(1):315-424
[7]Jiang Z, Akhtar Y, Bradbury R, et al. Comparative toxicity of essential oils ofLitsea pungens and Litsea cubeba and blends of their major constituents againstthe cabbage looper, Trichoplusia ni. Journal of Agricultural and Food Chemistry.2009,57(11):4833-4837
[8]Zhang W, Hu JF,LvWW,et al. Antibacterial, antifungal and cytotoxicisoquinoline alkaloids from Litsea cubeba. Molecules, 2012, 17(11):12950-12960
[9]余伯良.高效经济林木--山苍子.农村经济与科技,1999,10:28-29
[10]Wang Y, Jiang ZT, Li R.Complexation and molecular microcapsules of Litseacubeba essential oil with B-cyclodextrin and its derivatives. European FoodResearch and Technology, 2009, 228(6):865-873
[11]Liu ZL, Goh SH, Ho SH, Screening of Chinese medicinal herbs for bioactivitySitophilus zeamais Motschulsky and Tribolium castaneum(Herbst)againstJournal of Stored Products Research, 2007, 43(3):290-296
[12]赵铭钦,苏长涛,姬小明.山苍子油综合利用研究进展.安徽农业科学2007,35(25):7866-7868
[13]Hamed SF,Sadek Z,Edris A. Antioxidant and antimicrobial activities of clove bud essential oil and eugenol nanoparticles in alcoholfree microemulsion. Journal of Oleo Science, 2012,61(11):641-648
[14] 李锦绣.丁香现代药理研究进展.实用中医药杂志,2002.18:54-56
[15]Echegaray ER, Cloyd RA. Effects of reduced-risk pesticides and plant growth regulators on rove beetle(Coleoptera:Staphylinidae)adults. Journal of EconomicEntomology,2012,105(6):2097-2106
[16]Ouattara B, Simard RE, Holley RA, et al. Antibacterial activity of selected fatty acids and essential oils against six meat spoilage organisms. International Journal of Food Microbiology, 1997, 37(2-3):155-162
[17]Burt SA, Reinders RD, Antibacterial activity of selected plant essential oil sagainst Escherichia coli 0157:H7. Letters in Applied Microbiology, 2003.36(3):162-167
[18]Feres M, Figueiredo LC, Barreto I, et al. In vitro antimicrobial activity of plant extracts and propolis in saliva samples of healthy and periodontally-involved subjects. Journal of the International Academy of Periodontology, 2005.7(3):90-96
[19]赵晨曦,梁逸曾,李晓宁.丁香挥发油化学成分与抗菌活性研究.天然产物研究与开发,2006,3:81-85
[20]唐裕芳,张妙玲,张有毫.公丁香挥发油化学组成及抑菌活性研究.湘潭大学自然科学学报,2008,30(4):101-105
[21]Mytle N, Anderson G, Doyle M, et al. Antimicrobial activity of clove (Syzgiumaromaticum)oil in inhibiting Listeria monocytogenes on chicken frankfurters. Food Control, 2006, 17(2):102-107
[22]Chami F, Chami N, Bennis S, et al. Oregano and clove essential oils induce surface alteration of Saccharomyces cerevisiae. Phytotherapy Research, 200519(5):405-408
[23]Pawar V, Thaker V, In vitro efficacy of 75 essential oils against Aspergillus niger. Mycoses, 2006,49(4):316-323
[24]Kim HM, Lee EH, Hong SH, et al. Effect of Syzygium aromaticum extract on immediate hypersensitivity in rats. Journal of Ethnopharmacology,199860(2):125-131
[25]韩艳,王庆伟,张琰.丁香对幽门螺杆菌的体外抑制作用.医药导报,2011,30(3):302-303
[26]Hussein G, Miyashiro H, Nakamura N, et al. Inhibitory effects of Sudanese medicinal plant extracts on hepatitis C virus (HCV)protease. Phytotherapy Research, 2000,14(7):510-516
[27]Kim B, Kim J, Kim H, et al. Biological screening of 100 plant extracts for cosmetic use (l): anti-oxidative activity and free radical scavenging activity. International Journal of Cosmetic Science, 1997,19(6):299-307
[28] Ogata M, Hoshi M, Urano S. Antioxidant activity of eugenol and related monomeric and dimeric compounds. Chemical &Pharmaceutical Bulletin Publication, 2000,48(10):1467-1469
[29]Mihara S, Shibamoto T. Photochemical reactions of eugenol and related compounds: synthesis of new flavor chemicals. Journal of Agricultural and FoodChemistry,1982,30(6):1215-1218
[30]Atsumi T, lwakura l, Fujisawa S, et al. Reactive oxygen species generation and photo-cytotoxicity of eugenol in solutions of various pH. Biomaterials2001,22(12):1459-1466
[31]Jirovetz L, Buchbauer G Stoilova I, et al. Chemical composition and antioxidant properties of clove leaf essential oil. Journal of Agricultural and Food Chemistry,2006,54(17):6303-6307
[32]Gülçin i, Güngör $at i, Beydemir $, et al, Comparison of antioxidant activity of[32]clove (Eugenia caryophylata Thunb) buds and lavender ( Lavandula stoechas L.)Food Chemistry, 2004,87(3):393-400
[33]Ogunwande l, Olawore N, ekundayoO. Studies on the essential oil scomposition, antibacterial and cytotoxicity of Eugenia uniflara L. International Journal of Aromatherapy,2005,15(3):147-152
[34]Markowitz K, Moynihan M, Liu M, et al. Biologic properties of` eugenol and zinc oxide-eugenol: A clinically oriented review, Oral surgery, Oral medicine, AralPathology,1992,73(6):729-737
[35]Wagner E, Arndt R, Hilton B. Physiological stress responses, egg survival and[35]sperm motility for rainbow trout broodstock anesthetized with clove oil, tricaine methanesulfonate or carbon dioxide.Aquaculture,2002,211(1):353-366
[36]O'Brien DJ. Treatment of psoroptic mange with reference to epidemiology andhistory. Veterinary Parasitology, 1999,83(3-4):177-185
[37]Park IK, Shin SC. Fumigant activity of plant essential oils and components from garlic (Allium sativum) and clove bud (Eugenia caryophyllata) oils against the Japanese termite (Reticulitermes speratus Kolbe). Journal of Agricultural and Food Chemistry,2005, 53(11):4388-4392
[38]张雪梅,胡志宇.我国香茅属植物研究进展.中国民族民间医药,20093:14-15
[39]梁明龙,徐汉虹,朱彩云.香茅属植物活性成分在病虫害防治中的研究与应用.广东农业科学,2005,6:60-62
[40]纪淑娟,常波,张娜.香茅油对果蔬采后主要致病真菌的抑菌活性.食品工业科技,2010,31:81-83
[41]战广琴,黄有凯,李耀亭.香茅醛对黑曲霉有关形态及结构影响的研究.安徽农业大学学报,2003,30:220-223
[42]Specos M,Garcia J, Tornesello J,et al. Microencapsulated citronella oil for mosquito repellent finishing of cotton textiles. Transactions of the Royal Society of Tropical Medicine and Hygiene, 2010,104(10):653-658
[43]Güinter CM, Junnila A, Butler J, et al. Efficacy of the botanical repellents geraniol, linalool, and citronella against mosquitoes. Journal of Vector Ecology, 200934(1):2-8
[44]Ito S, Wakamatsu K. Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals: a comparative review, Pigment Cell Research,2003,16(5):523-531
[45]Simon JD, Peles D, Wakamatsu K,et al. Current challenges in understanding melanogenesis: bridging chemistry, biological control, morphology, and function. Pigment Cell & Melanoma Research, 2009, 22(5):563-579
[46] Ito S,Wakamatsu K,Chemistry of Mixed Melanogenesis-Pivotal Roles of Dopaquinone. Photochemistry and Photobiology, 2008, 84(3):582-592
[47]Dunford R,Land EI,Rozanowska M,et al. Interaction of melanin with carbon-and oxygen-centered radicals from methanol and ethanol. Free Radical Biology and Medicine, 1995,19(6):735-740
[48]Prota G, The role of peroxidase in melanogenesis revisited. Pigment Cell Research, 1990,3(2):25-31
[49]Hearing V,Unraveling the melanocyte. American Journal of Human Genetics.1993,52(1):1-7
[50]Hideay A, Hirofumi k, Masamitsu I. approaches to identify inhibition of melanin biosynthesis via the quality control of tyrosinase. Journal of Invesigative Dermatology, 2007,127:751-761
[51]Jimbow K,Alena F,Dixon W,et al. Regulatory Factors of Pheo - and Eumelanogenesis in Melanogenic Compartments. Pigment Cell Research, 19903:36-42
[52]Prota G. Progress in the chemistry of melanins and related metabolites. Medicinal Research Reviews, 1988,8(4):525-556
[53]Tückmantel W, Kozikowski AP, Romanczyk Jr LJ. Studies in Polyphenol Chemistry and Bioactivity, 1. Preparation of Building Blocks from (+)-Catechin Procyanidin Formation. Synthesis of the Cancer Cell Growth Inhibitor3-0-Galloy1-(2 R,3 R)-epicatechin-4β,8-[3-0-galloyl-(2 R, 3 R)-epicatechin]Journal of the American Chemical Society,1999,121(51):12073-12081
[54]Harborne JB, Williams CA. Advances in flavonoid research since 1992Phytochemistry,2000,55(6):481-504
[55]Kubo l, Kinst-Hori l. Flavonols from saffron flower: tyrosinase inhibitory activity[55]and inhibition mechanism. Journal of Agricultural and Food Chemistry,1999,47(10):4121-4125
[56] No JK, Soung DY, Kim YJ, et al. Inhibition of tyrosinase by green tea components. Life Sciences, 1999,65(21):24 1-246
[57] Badria F, Elgayyar M. A new type of tyrosinase inhibitors from natural products as potential treatments for hyperpigmentation. Bollettino Chimico Farmaceutico, 2001, 140(4):267-271
[58] Shimizu K, Kondo R, Sakai K. Inhibition of tyrosinase by flavonoids, stilbenes and related 4-substituted resorcinols: structure-activity investigations. Planta Medica, 2000, 66(1):11-15
[59] Hyo-Jin K, Gerald M, Sang-Won C. Isolation and identification of tyrosinase inhibitor from Galla rhois. Food Science and Biotechnology,1998, 7:56- -59
[60] Kubo I, Kinst-Hori I. Tyrosinase inhibitors from anise oil. Journal of Agricultural and Food Chemistry, 1998, 46(4):1268- 1271.
[61] Kubo I, Kinst-Hori I. Tyrosinase inhibitors from cumin. Jourmal of Agricultural and Food Chemistry, 1998, 46( 12):5338-5341
[62] Conrad JS, Dawso SR, Hubbard ER, et al. Inhibitor binding to the binuclear active site of tyrosinase: temperature, pH, and solvent deuterium isotope effects. Biochemistry, 1994, 33( 19):5739-5744
[63] Kahn V. Effect of kojic acid on the oxidation of L-DOPA, norepinephrine, and dopamine by mushroom tyrosinase. Pigment Cell Research, 1995, 8(5):234-240
[64] Parrish F, Wiley B, Simmons E, et al. Production of aflatoxins and kojic acid by species of Aspergillus and Penicillium. Applied Microbiology, 1966,14(1):139-140
[65] Wiley JW, Tyson Jr GN, Steller JS. The configuration of complex kojates formed with some transition elements as determined by magnetic susceptibility measurements. Jourmal of the American Chemical Society, 1942, 64(4):963-964
[66] Niwa Y, Akamatsu H. Kojic acid scavenges free radicals while potentiating leukocyte functions including free radical generation. Inflammation, 1991,15(4):303-315
[67] Hider RC, Lerch K. The inhibition of tyrosinase by pyridinones. Biochemical Journal, 1989, 257(1):289-290
[68] Goetghebeur M, Kermasha S. Inhibition of polyphenol oxidase by copper-metallothionein from Aspergillus niger. Phytochemistry, 1996, 42(4):935-940
[69] Kubo I, Chen QX,Nihei K. Molecular design of antibrowning agents: antioxidative tyrosinase inhibitors. Food Chemistry, 2003, 81(2):241-24
[70] Yu L. Inhibitory effects of (S)-and (R)-6-hydroxy-2, 5, 7, 8-tetramethylchroman-2-carboxylic acids on tyrosinase activity. Journal of Agricultural and Food Chemistry, 2003, 51(8):2344-2347
[71] Kubo I. Molecular design of antioxidative and antimicrobial agents. Chemtech, 1999, 29(8):37-42.
[72] Cleland J. The clinical course of heart failure and its modificafion by ACE inhibitors: insights from recent clinical trials. European Heart Journal, 1994, 15(1):125-130
[73] Espin JC, Wichers HJ. Effect of captopril on mushroom tyrosinase activity in vitro. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2001, 1544(1-2):289-300
[74] Bartosz M, Kedziora J, Bartosz G The copper complex of captopril is not a superoxide dismutase mimic. Artefacts in DMPO spin trapping. Free Radical Research, 1996, 24(5):391-396
[75] Andrawis A, Kahn V. Effect of methimazole on the activity of mushroom tyrosinase. Biochemical Journal, 1986, 235(1):91-96
[76] Kahn V, Andrawis A. Inhibition of mushroom tyrosinase by tropolone. Phytochemistry, 1985, 24(5):905-908
[77] McEvily AJ, Iyengar R, Otwell WS. Inhibition of enzymatic browning in foods and beverages. Critical Reviews in Food Science & Nutrition, 1992,32(3):253-273
[78] Masaki H, Atsumi T, Sakurai H. Detection of hydrogen peroxide and hydroxyl radicals in murine skin fibroblasts under UVB irradiation. Biochemical and Biophysical Research Communications, 1995, 206(2):474-479
[79] Jurkiewicz BA, Buettnerf GR. EPR detection of free radicals in UV - irradiated skin: mouse versus human. Photochemistry and Photobiology, 1996, 64(6):918-922
[80] Panov GI, Uriarte AK, Rodkin MA, et al. Generation of active oxygen species on solid surfaces. Opportunity for novel oxidation technologies over zeolites.Catalysis Today, 1998, 41(4):365-385
[81] Ryu A, Arakane K, Koide C, et al. Squalene as a target molecule in skin hyperpigmentation caused by singlet oxygen. Biological and Pharmaceutical Bulletin, 2009, 32(9):1504-1509
[82] Masaki H. Role of antioxidants in the skin: anti-aging effects. Jourmal of
Dermatological Science, 2010, 58(2):85-90
[83] Rhodes LE, Gledhill K, Masoodi M, et al. The sunburn response in human skin is characterized by sequential eicosanoid profiles that may mediate its early and late phases. The FASEB Journal, 2009, 23(11):3947-3956
[84] Chiba K, Kawakami K, Sone T, et al. Characteristics of skin wrinkling and dermal changes induced by repeated application of squalene monohydroperoxide to hairless mouse skin. Skin Pharmacology and Physiology, 2003, 16(4):242-251
[85] Kobayashi Y, Iwai I, Akutsu N, et al. Increased carbonyl protein levels in the stratum corneum of the face during winter. International Journal of Cosmetic Science, 2008, 30(1):35-40
[86] Niwa Y, Sumi H, Kawahira K, et al. Protein oxidative damage in the stratum corneum: evidence for a link between environmental oxidants and the changing prevalence and nature of atopic dermatitis in Japan. British Journal of Dermatology, 2003, 149(2):248-254
[87] Schallreuter KU, Moore J, Wood JM, et al. In vivo and in vitro evidence for hydrogen peroxide (H2O2) accumulation in the epidermis of patients with vitiligo and its succesful removal by a UVB-activated pseudocatalase. Journal of Investigative Dermatology Symposium Proceedings,1999, 4:91-96
[88] Pelle E, Mammone T, Maes D, et al. Keratinocytes act as a source of reactive oxygen species by transerring hydrogen peroxide to melanocytes. Journal of Investigative Dermatology, 2005, 124(4):793-797
[89] Sasaki M, Horikoshi T, Uchiwa H, et al. Up - regulation of Tyrosinase Gene by Nitric Oxide in Human Melanocytes. Pigment Cell Research, 2000, 13(4):248-252 .
[90] Wlaschek M, Heinen G, Poswig A, et al. UVA - induced autocrine stimulation of fibroblast -derived collagenase/mmp-1 by interrelated loop ofinterleukin-1 and interleukin-6. Photochemistry and Photobiology, 1994, 59(5):550-556
[91] Pinnell SR. Cutaneous photodamage, oxidative stress, and topical antioxidant protection. Journal of the American Academy of Dermatology, 2003, 48(1):1-18
[92] 李靖岩,吴景东.氧自由基损伤与皮肤美容及其预防措施.中国美容医学, 2009, 18(5):707-708
[93]申虹,陈晓玲,陈可吟.氧自由基与皮肤老化.中国美容医学,2005,4:498-499
[94] Bulteau AL, Moreau M, Nizard C, et al. Impairment of proteasome function upon UVA-and UVB-irradiation of human keratinocytes. Free Radical Biology and Medicine, 2002, 32(11):1157-1170
[95] 李志林,李强,孙宝山.化妆品用肤色纳米二氧化钛的制备.广东化工,2005, 7:1-2
[96] Lademann J, Weigmann H J, Rickmeyer C, et al. Penetration of titanium dioxide microparticles in a sunscreen formulation into the horny layer and the follicular
[97]Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms, 2004, 219:82-86
[98]薛承斌. 纳米TiO2透皮行为及紫外光诱导下致皮肤损伤的研究.华中科技大学博士学位论文, 2011.
[99] Tyner KM, Wokovich AM, Godar DE, et al. The state of nano-sized titanium dioxide (TiO2) may affect sunscreen performance. International Journal of Cosmetic Science, 2011,33(3),234-244
[100] Nohynek GJ,Dufour E.K, Roberts M.S, Nanotechnology, cosmetics and the skin: is there a health risk? Skin pharmacology and physiology,2008, 21:136-149
[101] Shen B, Scaiano JC, English AM. Zeolite Encapsulation decreases TiO2 - photosensitized ROS generation in cultured human skin fibroblastst. Photochemistry and Photobiology, 2006, 82(1): 5-12
[102] Kiss B, Bir6 T, Czifra G, et al. Investigation of micronized titanium dioxide penetration in human skin xenografts and its effect on cellular functions of human skin-derived cells. Experimental Dermatology, 2008, 17(8):659-667
[103] Contado C,Pagnoni A. TiO2 in commercial sunscreen lotion: flow field- flow fractionation and ICP-AES together for size analysis. Analytical Chemistry, 2008,80:7594-7608
[104] Paunel AN, Dejam A, Thelen S, et al. Enzymeindependent nitric oxide formation during UVA challenge of human skin: characterization, molecular sources, and mechanisms. Free Radical Biology Medicine, 2005,38: 606-615
[105] Vione D, Maurino V, Minero C,et al. Phenol photonitration upon UV irradiation of nitrite in aqueous solution II: effects of pH and TiO2. Chemosphere,2001,45:903-910
[106] Shibata H, Noda N, Ogura Y, et al. Oxidation and reduction of nitrite ion in the TiO2 photo-induced catalytic reaction. Bioscience Biotechnology Biochemistry,
2000,64: 1751-1753
[107] Ischiropoulos H. Biological selectivity and functional aspects of protein tyrosine nitration. Biochemical and Biophysical Research Communications, 2003,
305(3):776-783
[108] Turko IV, Murad F. Protein nitration in cardiovascular diseases. Pharmacological Reviews, 2002, 54(4):619-634
[109] Schopfer FJ, Baker PRS, Freeman BA. NO-dependent protein nitration: a cell signaling event or an oxidative inflammatory response? Trends in Biochemical Sciences, 2003, 28( 12):646-654
[110] Radi R. Nitric oxide, oxidants, and protein tyrosine nitration. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(12):4003-4008
未完待续……


