女 性 雄 激 素 性 脱 发 ( female androgenetic alopecia, FAGA)( ICD-10 编码:L 64.951 ) 又称“女性雄激素性秃发” “女性型脱发”,是女性常见的脱发类型,主要以渐进性毛囊微小化为临床特征。 近年来针对 FAGA 的病因、发病机制、分级、诊断、鉴别诊断及治疗等方面的诸多研究均表明,FAGA 与男性雄激素性脱发( androgenetic alopecia, AGA)) 有着明显差异。 FAGA 的诊断及治疗相对更复杂,对患者造成的心理影响更大,但目前有关 FAGA 的诊疗规范仅在以 AGA 为主的指南中提及,缺乏其独立的诊疗共识或指南。 基于此,专家组在既往 FAGA 诊疗规范的基础上经充分讨论、修改和补充,制定本版基于循证医学证据的临床诊疗专家共识,以规范和指导 FAGA 的临床诊疗。
专家共识的目标人群
适用于各种原因引起的 FAGA 患者。
专家共识的使用人群
针对各级各类从事毛发疾病相关工作的医师、护理人员、教学、科研人员,主要包括皮肤科、医学美容科、整形外科、妇产科、内分泌科、病理科、精神心理科、基础研究中心、科研教学团队等。
缩写词表
本共识中涉及的各缩写词的中、英文全称见表 1。

共识临床问题、推荐意见形成过程与方法
2021 年 11 月初,中华医学会整形外科学分会毛发移植学组牵头,邀请 27 位医学美容科、整形外科、皮肤科、妇产科及方法学、统计学领域专家,形成共识编写组。 2021 年 11 月中旬,举行专家会议讨论并提出本共识的 4 个临床问题。 本共识采用循证医学方法,检索 PubMed、Embase、Cochrane Library、中国生物医学文献数据库、万方数据库、中国知网和中文科技期刊全文数据库,检索时间截至 2021 年11 月 30 日。 2022 年 3 月 22 日和 27 日,进行两轮德尔菲法专家推荐意见函询,将专家意见汇总后最终形成 4 条推荐意见,于 2022 年 4 月 3 日草案定稿。2022 年 5 月 17 日,共识意见稿交由 9 位外部同行专家进行评审,根据其反馈意见和建议进行完善。
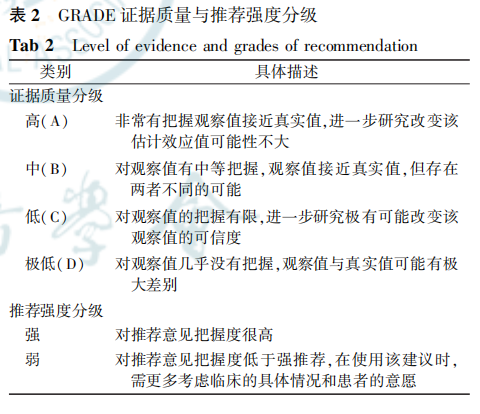
本共识采用推荐意见分级的评估、制定及评价(grading of recommendations assessment, developmentand evaluation, GRADE))方法,对证据质量和推荐意见的推荐强度进行分级。 GRADE 证据质量和推荐强度分级的含义见表2。专家意见的一致性分为极高、高、一般、不一致 4级。
FAGA 背景知识
一、命名、流行病学与病因学雄激素性脱发是从发病原因对该疾病进行命名,由于男女均可罹患此病,因此该病的名称比较多,对于男性而言,英文名称包括“androgenetic alopecia(AGA)”和“male-pattem hair loss( MPHL)”等;对于女性而言,英文名称包括“female androgenetic alopecia(FAGA)”和“female-pattern hair loss(FPHL)”等,临床中常使用“女性雄激素性脱发(FAGA)”“女性型脱发(FPHL)”“女性脂溢性脱发”等词描述这类疾病。由于雄激素与脱发之间的关系不确定,近来在国际上“女性型脱发(FPHL)”一词已成为皮肤科文献中更常见的女性脱发名称[1]。但考虑到国内的多种因素,本共识依旧使用“女性雄激素性脱发(FAGA)”以便于在我国的临床应用。
FAGA 的患病率随年龄增长而增加,且具有种族差异,亚洲女性 FAGA 患病率低于高加索人种女性。与 AGA 相比,FAGA 发病年龄相对较晚[2-4]一项在中国6座城市进行的包括8446名18岁以上女性的流行病学统计结果显示:中国FAGA 的整体患病率约为 6%,其中 18~29 岁为 1.3%,30~39 岁为2.3%,40~49 岁为5.4%,50~59 岁为7.5%,60~69 岁为 10.3%,70 岁以上为 11.8%[3]
FAGA 和 AGA 引起毛囊退化的最终途径相同,典型脱发的关键特征均是生长期缩短和受影响头皮中毛囊的微型化,但二者的病因不一致。多基因易感性和头皮中雄激素作用的增加似乎是AGA 和FAGA 头皮脱发的主要驱动因素[5]。头皮慢性低度炎症可能是 FAGA 脱发的另一个驱动因素[6]。其中雄激素在 AGA 发病机制中的作用已经基本明确而在 FAGA 发病中的作用尚不清楚。除雄激素外FAGA 可能还涉及非雄激素依赖途径。有研究数据表明,仅 1/3 的 FAGA 患者雄激素水平异常[7]。在雄激素不敏感综合征(一种性染色体遗传疾病,由位于X染色体上的雄激素受体基因突变所致)患者中,也有罹患 FAGA 的报道[8]。此外,研究发现妊娠期间生长期毛囊比例增加,绝经后FAGA 患病率增加,说明雌激素可能对人类头发生长有保护作用[9]”。一项癌症患者应用内分泌治疗后脱发发生率的 meta 分析表明:使用他莫昔芬或芳香化酶抑制剂治疗的癌症患者相比对照组有较高的脱发风险[10]。在女性甲状腺功能亢进症患者中可观察到弥漫性脱发的现象,有研究表明甲状腺素可增强雄激素受体的作用,因此推测甲状腺素可能与FAGA相关[11]。也有研究发现 FAGA 患者中血浆催乳素升高者多于正常对照组,考虑是由于催乳素升高导致雌激素减少,而雌激素可抑制雄激素作用,最终导致雄激素作用增强。代谢综合征也可导致脱发,如高血糖造成血管损伤,血管损伤引起毛囊周围微环境变化,从而导致脱发[12].
大约 50%的 FAGA 患者有女性脱发的家族史,表明 FAGA 发病存在遗传因素!]。易感基因促使正常循环水平的雄激素作用于毛囊靶细胞,结合特定的细胞内敏感性增强的雄激素受体而导致 FAGA的发生。
此外,在 FAGA 脱发患者中,毛囊漏斗部周围区域出现轻至中度淋巴细胞炎性浸润,并伴有微型化「13]。发生在毛囊上部的炎症过程表明,多种因素如紫外线辐射、环境污染物、皮肤微生物群等导致的微炎症也与 FAGA 相关[6]
二、FAGA 的临床表现
FAGA 通常表现为缓慢进行性毛发稀疏,主要累及额部、中央区及顶区。虽然部分 FAGA 患者其前额发际线不像男性一样后退,且毛囊微小化程度没有男性严重,但其毛发稀疏范围广,可累及顶部及后枕部,也可累及题侧。这可能会对毛发移植手术获取供区毛囊造成困难。
FAGA 主要有3种临床表现:(1)顶区毛发弥漫性稀疏,前发际线保留(图1A)[14];(2)前额中部发际线后退,中央发缝增宽,呈“圣诞树”样外观(图1B)[5];(3)双侧额颞角后退,可出现顶部稀疏,与男性 AGA 相似(图 1C)[16]
FAGA共识相关临床问题.
一、临床问题1:FAGA的诊断依据及鉴别诊断要点有哪些
(一)推荐意见
目前FAGA为症状性诊断,以病史和临床表现(症状和体征)为主要诊断依据。当患者出现前述3种模式分布的脱发表现(见“FAGA背景知识”中“二、FAGA的临床表现"),并且拉发试验通常为阴性,毛发镜下表现为毳毛比例增加、毛发直径异质性增加、脱发区域头皮黄点征,此时可进行症状性诊断。同时,患者有AGA家族史、脱发持续时间长且脱发进行性加重等信息也可为诊断提供依据。必要时可针对性做--些实验室检查,以排除其他病因引起的脱发。[ 证据等级:极低(D);推荐级别:弱推荐;专家意见-一致性高(77%)]
FAGA与休止期脱发( telogen efluvium,TE)、弥漫性斑秃( diffuse alopecia areata)、额部纤维性秃发( frontal fibrosing alopecia, FFA)、模式性分布的纤维化性秃发( fibrosing alopecia in a pattern distribution,
FAPD)的部分临床表现较为相似,需要进行鉴别诊断(表3)。

1. TE
TE的发病机制是短期内进入休止期的毛囊数量增多,从而导致出现毛发脱落增加现象。该病通常在压力事件(减肥.抑郁、妊娠、创伤、重大手术、病毒感染等)之后出现,或由药物、营养不良、内分泌失调引起。急性TE 一般表现为广泛弥漫性毛发稀i疏,也可表现为双侧颞部显著后退。拉发试验通常呈阳性(用拇指、食指和中指夹捏40~60根毛发,顺毛干方向以适当力度牵拉毛发,计数脱落毛发数量,若脱落毛发数量大于5根为拉发试验阳性)。毛发镜及毛发显微镜检查可提供一-些诊断线索:如脱落头发中休止期毛发比例增加,较多空白毛囊与直立新生发。但需注意的是,FAGA也可合并TE。
2.弥漫性斑秃
弥漫性斑秃是一种较少 见的斑秃,主要发生在年轻女性中。此病患者通常缺乏典型的斑片状特征,主要以突然出现的弥漫性脱发为特征,急性期时头皮活检常发现末梢毛球周围炎性浸润。拉发试验通常呈阳性。毛发镜检查显示断发、弥漫分布的黄点、黑点和营养不良发等斑秃特征性表现。活组织检查有助于确诊。
3. FFA
1994年Kossard[17]首次描述了FFA。FFA是一种病因不明的永久性瘢痕性秃发,被认为是毛发扁平苔藓( lichen planopilaris, IPP )的临床变异,主要见于绝经后的中年妇女,但男性和绝经前女性也可
发生。激素变化、遗传易感性环境因素和自身免疫状态均被认为与FFA有关。FFA主要表现为前额发际线渐进性退缩,最终发际线可后退至颞部和顶部,孤发征(几根孤立的终毛位于前额,远离后退的发际线)为其特征性表现。拉发试验通常为阴性。毛发镜检查显示毛囊周围红斑、毛囊口角化过度、局部萎缩呈苍白色,额颞发际线无毛囊。组织学可显
示典型的苔藓样毛囊周围淋巴细胞浸润,与毛周板层纤维化有关,主要累及毳毛毛囊。FAPD是- -种模式性秃发,因其临床表现、毛发镜及病理表现与FFA类似,因此有学者认为FAPD为FFA的一种亚型。
(二)证据概述
共识意见编写组进行定性研究发现,脱发这一症状可出现在多种器质性或精神性疾病中,且常为这些疾病的第- -主诉。但目前还未检索到关于FAGA的指南、专家共识、系统评价、前瞻性研究等高质量证据。
(三)推荐说明
所有导致高雄激素血症的疾病,如卵巢或肾上腺肿瘤、多囊卵巢综合征和肾上腺增生,都有可能导致女性脱发。其中大约20%的多囊卵巢综合征患者患有FAGA[18]。以肥胖、胰岛素抵抗、高血压、高催乳素血症和醛固酮水平升高为特征的代谢综合征也经常与FAGA相关[19]。初诊医师应详细询问病史并结合毛发镜检查进行诊断。建议皮肤科和医学美容科为FAGA患者就诊科室,必要时联合内分泌科和妇产科等多学科会诊。
二、临床问题2:FAGA分级体系如何选择
(一)推荐意见
推荐BASP ( basic and specifie classification) 分级,结合毛发镜和其他相关实验室检查,综合评估、治疗女性脱发。[证据等级:中( B);推荐级别:强推荐]
以诊断方案为导向的疾病分级体系对于指导FAGA规范化治疗具有重要价值。目前国际上较为通用的分级方法包括Ludwig 分级[4)、Sinclair's 分级[20]、Olsen's 分级[5]和BASP分级[2]。上述分级对临床医生使用、记忆和疾病诊断有一定帮助,但是对于治疗的指导意义有限。原因在于:(1)各型之间界定不清晰,缺乏客观的分级标准,容易因临床经验不同而误判,以至于医生之间评估的一致性较低;(2)分级主要考虑毛发分布、密度和头皮显露之间的关系,对毛发的直径和毳毛/终毛的比例以及局部头皮病理特性描述较为笼统,尤其是对女性高雄激素血症及代谢综合征均未提及,故其对因高雄激素血症和代谢综合征引起的脱发的治疗指导价值有限。结合现有分级体系,选择具有临床指导意义的体系对于治疗方案的选择具有深远影响。
(二)证据概述
共识意见编写组研究发现,查找到4篇关于FAGA分级体系的描述14-152021], Ludwig分级对于FAGA头顶部毛发稀疏、发缝增宽、头皮显露程度直观;而Sinclair's分级(头皮中部临床分级量表)采用视觉模拟分级,主要用于正在接受治疗的FAGA患者;BASP兼顾发际线位置改变和毛发密度改变两方面,具有全面性、系统性和渐进性的优点,适合临床医生使用和记忆。前述4种描述是根据脱发部位毛发稀疏程度和头皮显露程度进行,直观形象,便于使用和记忆,但是缺乏客观性描述指标,与病因学相关性有限。4种FAGA分级体系的优缺点见表4。

(三)推荐说明
通过德尔菲调查法,对目前已发表的分级体系的优缺点进行归纳评价。 本推荐基于一致性高的专家建议,形成推荐意见。 年龄是疾病发展、严重程度分级评估、治疗方案选择的重要参考指标,FAGA 具有缓慢进展的特性(尤其青春期后患者),分级一般都随年龄增加而加重。 建议使用 BASP 方法对初诊患者进行脱发分级,并结合毛发镜对患者毛发进行整体摄影、毛发直径及密度测量。 毛发镜下所得客观指标更有助于了解疾病进程、术前评估设计、治疗效果的监测,未来可将该类客观指标纳入分级评估体系中。
三、临床问题 3:FAGA 诊断流程及治疗评估有哪些
(一)推荐意见
推荐建立规范合理的诊断流程,进行良好的治疗评估,给出明确治疗方案。 检查内容见表 5,6。[证据等级:中(B);推荐级别:强推荐]


注:PCOS 为多囊卵巢综合征:TPHA为梅毒螺旋体血凝试验:TPPA为梅毒螺旋体抗体检测:RPR 为快速血浆反应素试验:TRUST
为甲苯胺红不加热血清试验
Note:PCOS,polycystic ovarian syndrome. TPHA. treponema pallidumhemagglutination test. TPPA, treponema pallidum antibody. RPR, rapid plasma reagin test. TRUST, tolulized red unheated serum test.
首诊医生应具备全面扎实的毛发疾病诊疗的综合能力。 首诊医生应针对患者临床症状、发病时间、进展情况进行充分询问,详细进行体征、毛发镜及相关实验室检查[22] 。 在排除其他需要鉴别诊断的脱发疾病后可做出 FAGA 诊断。 对于疑难病例,推荐患者进行包括医学美容科、皮肤科、内分泌科、妇产科、病理科及精神心理科在内的多学科联合诊治。对于明确需要通过毛发移植等外科手术治疗的病例,应严格执行毛发移植手术术前评估、方案制定、术前告知、术中严格流程管理及术后随访,术后的配合治疗也要及时跟进,给予患者满意的治疗效果。
毛发镜检查在FAGA 诊断中起到重要作用FAGA 的主要特征是毛发直径异质性>20%231;此外,FAGA 患者毳毛比例增加,毛囊单位中毛发数目减少,伴有黄点征、毛周征和色素改变[24]。镜下是否存在毛囊开口有助于与瘢痕性秃发鉴别。2009年Rakowska 等[2]提出了 FAGA 诊断的主要和次要毛发镜检查标准(表 7)。

(二)证据概述
综合共识编写组专家意见发现:FAGA诊断流程已经得到广泛推广和应用。对于毛发镜以及相关实验室检查指标的推荐,检索到相关治疗指南、系统评价等高质量证据,对FAGA 的诊断和治疗具有很好的指导意义。对于疑难复杂案例,尤其是需要非手术和手术联合治疗的案例,需要多学科联合诊治并评估治疗效果,以提高患者满意度。
(三)推荐说明
共识意见编写组开展定性研究,基于已获得证据中出现频率较高的症状和体征,并通过德尔菲调查法,结合一致性高的专家意见形成推荐意见。
四、临床问题 4:FAGA 合理的治疗方案有哪些,优劣如何
(一)推荐意见
早发现、早诊断、个性化及多学科联合的综合治疗模式具有精准诊断、提高疗效、延缓病程进展的作用。 [证据等级:低(C);推荐级别:弱推荐;专家意见一致性高(81%)]
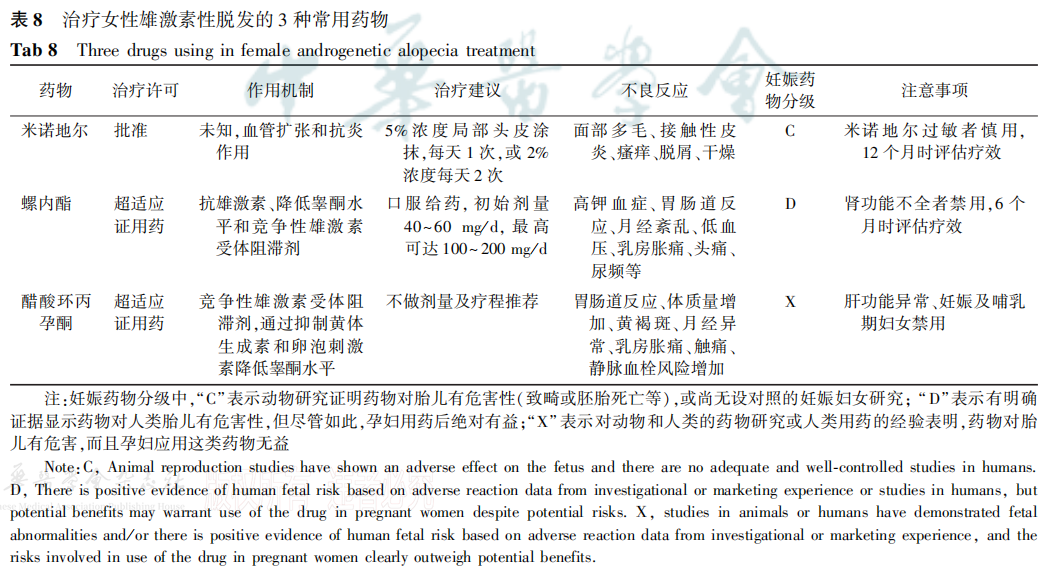
FAGA 是一种进展缓慢、病因复杂、机制尚未明确的疾病,治疗的目的是延缓或者阻止脱发进展;至少需要 3~ 6 个月才能有明显效果。 目前尚无任何方法可治愈FAGA。FAGA治疗原则:早发现、早诊断,并采用个性化及多学科联合的综合治疗模式,以延缓疾病进展,改善患者外观,提高生活品质。 治疗 FAGA 的 3 种常用药物见表 8。
1.外用米诺地尔
米诺地尔对毛发生长的确切作用尚未完全清楚,可能与米诺地尔作为一种具有血管扩张作用的钾通道开放剂,诱导毛囊周围的血管生成有关。另外,米诺地尔可通过增强 B-连环蛋白活性和刺激毛囊增殖、分化,延长毛囊的生长期[26]。
米诺地尔常用浓度分为 5%及 2%。目前对于FAGA 患者的推荐剂量为5%米诺地尔每日1次,每次1 ml,或者 2%米诺地尔每日2次,每次1 ml。国内外研究表明:使用高浓度(5%)米诺地尔外用治疗 FAGA 的效果优于低浓度(2%)米诺地尔[27-29]外用米诺地尔是 FAGA 的基础用药,其中5%米诺地尔使用更方便、经济。
外用米诺地尔最常见的不良反应为接触性皮炎及面部多毛症[2,30]。目前尚缺乏妊娠期外用米诺地尔安全性的研究,故妊娠期建议停止外用米诺地尔。哺乳期不推荐使用。
2.螺内酯( spironolactone)
螺内酯为一种保钾利尿剂,通过竞争性阻断雄激素受体抑制卵巢雄激素的产生,起到雄激素拮抗剂的作用。它是治疗 FAGA 常用的抗雄激素药物。其推荐的初始剂量通常为 40~60 mg/d口服,最高可达 100~200 mg/d[u。至少持续3个月后评估其疗效。疗程建议至少6~12 个月。螺内酯的不良反应包括体位性低血压、电解质紊乱、月经异常、疲劳,荨麻疹和乳房胀痛。治疗过程中需注意监测心电图、血压及血清钾浓度。
3.醋酸环丙孕酮(cyproterone acetate,CPA)
CPA 可阻断雄激素受体,通过抑制黄体生成素/卵泡刺激素-性腺轴来降低睾酮水平,从而起到拮抗雄激素的作用2。CPA在欧洲和加拿大被批准用于治疗多毛症、痤疮和 FAGA。CPA 不良反应包括黄褐斑、月经异常、体质量增加、乳房胀痛、性欲下降、抑郁、恶心、静脉血栓栓塞风险增加等。
目前各种研究中使用的CPA治疗剂量各不相同[32]。2018 版国际多囊卵巢综合征管理指南中建议,可使用短效口服避孕药改善多卵巢患者雄激素过多症及月经紊乱的情况,但其同时指出CPA 联合炔雌醇配伍的短效口服避孕药有导致血栓的风险,已不建议作为一线用药[。因此该方法仅在其他方法效果欠佳时考虑使用,且应与患者充分沟通利弊。其他与 CPA 类似的孕激素或短效避孕药(如屈螺酮炔雌醇片、屈螺酮炔雌醇片Ⅱ),可在与患者充分沟通的情况下用于部分严重的 FAGA 患者或月经紊乱者。
4.低能量激光治疗( low-level laser therapy.LLLT)
2011 年,LLT 获美国 FDA 批准用于治疗FAGA。其机制尚不完全清楚,LLIT 对组织具有生物刺激作用,被认为可以延长毛囊生长期,刺激毛囊从休止期重新进人生长期,并抑制毛囊过早进入到退化期。LLLT 产品形式多样,不同的 LLT 产品光源数量与能量密度有差异,因此治疗频率从每日1次至每周多次不等,单次治疗时间差异也较大,LLLT 治疗的不良反应较少,个别患者在照射期间可出现头晕、头皮瘙痒以及机器重量导致的头皮压迫不适等。
5.自体毛发移植( hair transplantation)
对于成人 FAGA 患者,若药物治疗无反应,疾病处于稳定状态,可根据不同的脱发等级推荐是否进行自体毛发移植。自体毛发移植手术的原理是用外科手术的方法将自身后枕部优势供区的毛发移植到秃发或者毛发稀疏的部位。理想的手术适应证是供区有可移植的优质毛发。术前正确评估及医患沟通是成功的关键。根据毛囊获取方式的不同,将其分为头皮条切取毛囊单位移植技术(follicular unitransplantation,FUT)和毛囊单位钻取术(folliculalumit extraction,FUE)[]。根据实际情况和医师建议选择适合的术式。移植的毛发在术后2~4周开始出现不同程度的脱落,术后3~6个月重新长出,术后6~9个月才可看到明显效果。移植后应继续使用米诺地尔或相关防脱发治疗。自体毛发移植的不良反应包括早期暂时性脱发、局部皮肤刺激、疼痛、感觉异常和感染等。
6.微针治疗( microneedling)
微针治疗是一种微创技术,使用微小针头造成皮肤轻微损伤。微针治疗能够刺激生长因子的产生,增强胶原蛋白和弹性蛋白的产生,并创建微通道,增加药物(如米诺地尔或富血小板血浆)透皮吸收。单个病例报道、系列病例报道及随机对照试验均明确微针联合其他常规方法治疗FAGA的有效性。微针治疗的不良反应包括治疗部位疼痛或不适、出血、感染和颈部淋巴结肿大[3]
7.富血小板血浆( platelet-rich plasma,PRP)
PRP 是一种自体浓缩的含血小板血浆,由多种不同的生长因子组成,包括血小板衍生生长因子、转化生长因子 α、血管内皮生长因子、胰岛素样生长因子1、表皮生长因子、碱性成纤维细胞生长因子、转化生长因子 B1和血小板活化因子。这些细胞因子可调节细胞的增殖、分化和血管生成。
有研究报道,使用不等剂量的 PRP 进行多次局部注射治疗后,头皮的上皮组织增厚,胶原纤维和成纤维细胞增生,毛囊周围血管增多[36]。但由于 PRP的制备方法尚无统一标准,治疗有效率各不相同,国内外指南均把PRP 作为AGA 治疗的辅助手段[32,37]。针对常规治疗欠佳的 FAGA 患者,PRP 是一种辅助治疗选择。
PRP 治疗后未报告严重不良事件。在一部分受试者中观察到轻微的不良反应,如注射点的短暂水肿、瘙痒、压痛和短暂出血。
8.其他
(1)非那雄胺:非那雄胺通过抑制亚型 5x-还原酶,减少睾酮转化为活性更高的二氢睾酮。由于存在男性胎儿女性化的风险,FDA未批准其在女性中使用,且禁止在妊娠和哺乳期使用。目前缺乏口服非那雄胺治疗 FAGA 效果的大规模研究数据,并且已有文献报道中的疗效相互矛盾[38-39],因此现阶段不做临床推荐。
(2)口服米诺地尔:尽管有研究证明小剂量口服米诺地尔可改善患者的头发密度,可能是一种治疗 FAGA 的有效方法[40-4],但目前国内尚无口服剂型米诺地尔,且无标准治疗剂量推荐,故现阶段不作临床推荐。其不良反应有体位性低血压、液体潴留和多毛症等。
(3)中药:中医药治疗 AGA的研究很多,但大多证据等级不高。其主要以扶正祛邪、标本兼治、内外兼治为治疗原则。以下仅列举文献或会议中报道使用的治疗方法。①丹参酮胶囊:功效是抗菌、消炎,具有雌性激素样活性;适用于湿热内蕴证,不良反应尚不明确[4]。②当归苦参丸:功效为凉血,袪湿;适用于湿热内蕴证,不良反应尚不明确[4]。③精乌胶囊:功效为补肝肾,益精血,壮筋骨;适用于肝肾不足证,不良反应尚不明确:且该对照研究选取的对象为男性 AGA 患者[]。④活力苏口服液:功效为益气补血,滋养肝肾:适用于肝肾不足证,不良
反应尚不明确[43]。
(4)口服营养补剂:口服补充氨基酸、维生素微量营养素在治疗包括 FAGA 在内的脱发中的作用是有争议的。尚不确定营养补剂治疗FAGA 的有效性。
(5)遮挡伪装品(camouflaging products)--文发、发片、假发:脱发患者可选择全部或部分假发、头发延长、隐形粉/喷雾、手术文身等方法,覆盖头皮暴露区域,从而隐藏脱发外观。这些产品或方法最适合轻度至中度脱发的女性,而重度脱发的女性在使用后可能无法获得自然外观。此外,伪装产品与外用米诺地尔等治疗方法可同时使用。头皮微着色文发是掩盖 FAGA 的有效方法之一。
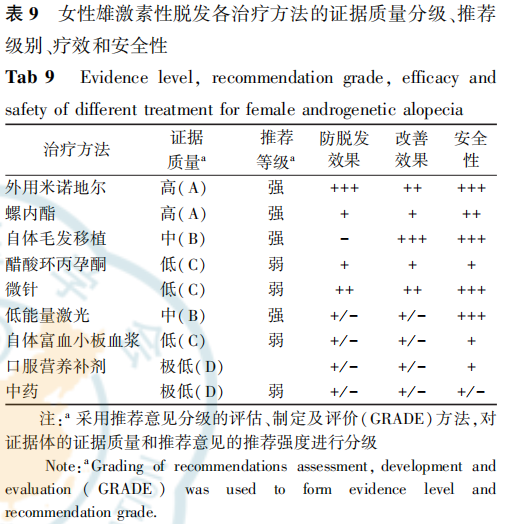
FAGA各治疗方法的证据质量分级、推荐级别疗效和安全性汇总情况见表9。
(二)证据概述
共识意见编写组进行研究发现,在FAGA 诊疗过程中,针对不同的伴随疾病,检索到相关治疗、系统评价、前瞻性研究等证据,但因 FAGA 发病原因和机制尚不明确,目前尚无特效的治疗药物或者技术,实施毛发移植手术的前提条件是要有稳定、足够的供区。随着脱发诊治手段的发展和预后效果的评估,越来越多的学者建议早期联合干预,可以明显延缓疾病发展,制定个性化多学科联合的治疗模式是FAGA 的推荐方式,对于改善患者的预后及心理、提高患者的总体满意度具有重要意义。
(三)推荐说明
共识意见编写组开展研究,基于已获得证据中出现频率较高的治疗方案,通过德尔菲调查法,结合一致性高的专家意见形成推荐意见。
总 结
FAGA 的诊断和治疗比男性 AGA 复杂,不仅需要了解可能的潜在原因及伴随疾病,对疾病进行充分鉴别诊断并提供各种可用的治疗方法,还需要了解脱发对患者的潜在心理影响、对治疗效果的期望值以及疗效欠佳引起的抑郁、焦虑等心理反应。
FAGA 需要早发现、早诊断、个性化及多学科规范化综合治疗。 目前的药物治疗可延缓或者阻止疾病进展,也可以刺激部分毛囊再生。 无论使用哪种药物,起效时间均较长,需要患者和临床医生的耐心是一种治疗选择,临床医生需要综合考量,为患者提供改善外观的多元化方法。
共识外审意见
FAGA 在人群中患病率高,且其与男性 AGA 在病因、诊断、治疗等方面均有所不同。 目前我国尚无专门针对 FAGA 的共识类文件对临床医生的诊疗工作进行指导,因此该“女性雄激素性脱发诊断与治疗中国专家共识(2022 版)” (下文简称“共识”)的制定与发表有临床需求。
该共识专家组主要由整形科、皮肤科专家构成,还包含公共卫生专业、营养与健康专业方面的从业人员,在专家组的构成方面具有较好的代表性。“共识”在证据的检索与梳理、专家意见的讨论与共识的达成、外审组的答辩与修订方面,整体过程透明、客观。
在“共识”的科学问题描述方面有以下问题需要注意:(1)对于 FAGA 的患病率描述,“共识”中提供的支持研究的调查对象对我国女性人群的代表性不高,更接近真实的患病率需进一步考证。 (2) “共识”中推荐意见的阐述方式条理性需要加强,便于读者参考。 (3)GRADE 分级中关于“强推荐”和“弱推荐”的定义,对该体系不熟悉的使用者可能会产生理解上的偏差,建议工作组在后续的共识推广中注意解释“弱推荐”的真实含义是“对该推荐意见把握度低于强推荐,在使用该建议时,需更多考虑临床的具体情况和患者的意愿”。 (4)该“共识”的受益人群广泛,建议后续可以在本版共识的基础上制定患者版,并进行相关科普,有利于提高患者的知晓度和依从性。
(外审意见总结及撰写人:何乐人)
执笔专家:
张菊芳(浙江大学医学院附属杭州市第一人民医院医学美容科)、程含品(浙江大学医学院附属杭州市第一人民医院医学美容科)、周易(杭州市第九人民医院医疗美容科)
专家组成员(按姓氏汉语拼音排序):
制订工作组成员
陈娟(西安国际医学中心整形医院)、程含品(浙江大学医学院附属杭州市第一人民医院医学美容科)樊一斌(浙江省人民医院皮肤科)胡志奇(南方医科大学南方医院整形外科)蒋文杰(中国医学科学院整形外科医院毛发移植中心)、李宇飞(上海市东方医院整形外科)、林尽染(复旦大学附属华山医院皮肤科)龙笑(北京协和医院整形美容外科)、吕中法(浙江大学医学院附属第二医院皮肤科)马辰浩[中国医学科学院整形外科医院整形外科,哈佛大学临床流行病学(循证医学外科方向)博士后】苗勇(南方医科大学南方医院整形外科)、牛冬(浙江农林大学动物科技学院)沈海燕(浙江大学医学院附属杭州市第一人民医院医学美容科)汪振星(华中科技大学同济医学院附属协和医院整形外科)魏爱华(首都医科大学附属北京同仁医院皮肤科)、吴(上海交通大学医学院附第九人民医院整复外科)、吴文育(复旦大学附属华山医院皮肤科)、徐骁(浙江大学医学院附属杭州市第一人民医院)、薛萍(空军军医大学第一附属医院整形外科)、杨顶权(中日友好医院毛发医学中心)、杨旅军(汕头大学医学院第二附属医院整形外科)、张菊芳(浙江大学医学院附属杭州市第一人民医院医学美容科)、张亮(中国科学院上海营养与健康研究所)张治芬(杭州市妇产科医院妇产科)、赵恒光(重庆医科大学附属第二医院皮肤科)周强(浙江大学医学院附属邵逸夫医院皮肤科)周易(杭州市第九人民医院医疗美容科)
秘书组成员
蒋宙男(浙江中医药大学)、江南一[医巢(杭州)医疗投资有限公司]、孙仲鑫[医巢(杭州)医疗投资有限公司1、赵钧(杭州市萧山区第一人民医院整形外科)周圳滔(杭州市老年病医院烧伤整形科)
外审专家(按姓氏汉语拼音排序):陈耀龙(兰州大学健康数据科学研究院、中国医学科学院循证评价与指南创新单元)顾建英(复旦大学附属中山医院整形外科)、何乐人(中国医学科学院北京协和医学院整形外科医院整形七科)蒋海越(中国医学科学院北京协和医学院整形外科医院整形七科)林晓曦(上海交通大学医学院附属第九人民医院整复外科)栾杰(中国医学科学院北京协和医学院整形外科医院整形八科)祁佐良(中国医学科学院北京协和医学院整形外科医院整形十六科)孙家明(华中科技大学同济医学院附属协和医院整形外科)、尹宁北(中国医学科学院北京协和医学院整形外科医院整形一科)
利益声明 本文作者与论文刊登的内容无利益关系
志谢 《中华整形外科杂志》编辑部在本共识的制定和撰写规范方面给予了全过程的指导,特此鸣谢
参考文献
[1]Sinclair R. Winding the clock back on female androgeneticalopecia[J]. Br J Dematol,2012,166(6):1157-1158. DO1:10.1111/i.1365-2133.2012.10934.x.
[2]Paik JH, Yoon JB, Sim wY, et al. The prevalence and types of andrgenetic alopecia in Korean men and women」]. Br .Dermatol,2001.145(1):95-99.DO: 10.1046/i.1365-21332001.04289.x.
[3]Wang TL,Zhou C,Shen YW, et al. Prevalence of androgeneticalopecia in China: a community-based study in six citiesl. BI Dermatol,2010,162(4):843-847.DO: 10. 1111/i.13652133.2010.09640.x.
[4]]Su LH,Chen IS,Chen HH. Factors associated with femalepattemn hair loss and its prevalence in Taiwanese women: acommunity-based survey[Jl.Am Acad Demmatol, 2013,69(2):e69-77.DOI:10.1016/i.jaad.2012.09.046
[5]Fabbrcini G,Cantelli M, Masarà A,et al. Female pattern hairloss : a clinical, pathophysiologic , and therapeutie review Jl. IntI Womens Dermatol,2018.4(4):203-211. DO1: 10.1016/iiiwd.2018.05.001.
[6]Mahé YF, Michelet JF, Billoni N,et al. Andrgenetic alopecia6and microinflammationJ. Int 」 Dermatol. 2000.39(8):576584.DOI:10.1046/.1365-4362.2000.00612.x.
[7]Futterweit W, Duna if A, Yeh HC, et al. The prevalence of hyperandrogenism in 109 consecutive female patients with diffuse alopecia[J]. J Am Acad Dematol,1988,19(5 Pt1):831-836DOI:10.1016/s0190-9622(88)70241-8.
[8]Cousen P,Messenger A. Female pattem hair loss in completeandrogen insensitivity syndrome[Jl. Br J Dermatol, 2010.162(5):1135-1137.D0:10.1111/i.1365-2133.2010.09661.x.
[9]Gizlenti S, Ekmekci TR. The changes in the hair cycle duringgestation and the post-partum period J]. J Eur Acad DermatolVenereol,2014,28(7):878-881.DO: 10.1111/idv.12188.
[10]Saggar V,WuS,Dickler MN, et al. Alopecia with endocrinetherapies in patients with cancer[J]. Oncologist, 2013,18( 10):1126-1134. D0I: 10. 1634/theoncologist.2013-0193.
[11] Lause M,Kamboj A, Fernandez Faith E. Dermatologie manifestations of endocrine disorders[J]. Transl Pediatr, 2017,6 (4) :300-312. DOI: 10. 21037/tp.2017. 09. 08.
[12] Coogan PF, Bethea TN, Cozier YC, et al. Association of type 2 diabetes with central-scalp hair loss in a large cohort study of African American women[J]. Int J Womens Dermatol, 2019,5
(4) :261-266. DOI: 10. 1016/j.ijwd.2019. 05. 010.
[13] Merlotto MR,Ramos PM,Miot HA. Pattem hair loss: . assessment of microinflammation in miniaturized and terminal hair follicles through horizontal histologie sections[J]. J Am Acad
Dermatol, 2020, 83 (2): e145-e146. DOI: 10. 1016/j. jaad. 2020. 03. 119.
[14] Ludwig E. Cassification of the types of androgenetic alopecia ( common baldness) occurring in the female sex[J]. Br J Dermatol,1977, 97 ( 3): 247-254. DOI: 10. 111/j. 1365- 2133. 1977.tbl5179.x.
[15] Olsen EA. The midline part: an important physical elue to the clinical diagnosis of androgenetie alopecia in women[J]. J Am Acad Dermatol, 1999 , 40( 1): 106-109. DOI: 10. 1016/s0190-
9622(99) 70539-6.
[ 16] Hamilton JB. Pattemed loss of hair in man; types and incidence [J]. Ann N Y Acad Sci, 1951, 53( 3): 708-728. DOI: 10. 111/j.1749-6632. 1951.tb31971.x.
[ 17] Kossard S. Postmenopausal frontal fibrosing alopecia. Searring alopecia in a pattern distribution[J]. Arch Dermatol, 1994, 130 (6) :770-774.
[18] Quinn M, Shinkai K, Pasch L, et al. Prevalence of androgenie alopecia in patients with polycystic ovary syndrome and characterization of associated clinical and biochemical features [J]. Fertil Steril, 2014, 101( 4):1129-1134. D0I: 10. 1016/j. fertnstert.2014. 01. 003.
[19] EI Sayed MH,Abdallah MA, Aly DG, et al. Association of metabolic syndrome with female pattem hair loss in women: case-control study[J]. Int J Dermatol, 2016, 55( 10):1131- 1137. DOI: 10. 111/jd.13303.
[ 20] Sinclair R, Wewerinke M, Jolley D. Treatment of female pattern hair loss with oral antiandrogens[J]. Br J Dermatol, 2005 , 152 (3) :466-473. DOI: 10. 111/j. 1365-2133.2005. 06218.x.
[21] Lee Ws, Oh Y, Ji JH, et al. Analysis of familial factors using the basic and specific ( BASP ) classification in Korean patients with androgenetie alopecia[J]. J Am Acad Dermatol, 2011 , 65(1):
40-47. DOI: 10. 1016/j.jaad.2010. 05. 005.
[22] Alessandini A, Starace M, D' Ovidio R, et al. Androgenetice alopecia in women and men: Italian guidelines adapted from European Dermatology Forum/ European Academy of Dermatology and Venereology guidelines[J]. G Ital Dermatol Venereol, 2020 , 155(5) :622-631. D0I: 10. 23736/S0392-0488. 19. 06399-5.
[23] de Lachariere 0, Deloche C, Misciali C, et al. Hair diameter diversity: a clinical sign reflecting the follicle miniaturization[ J]. Arch Dermatol, 2001 ,137(5) :641-646.
[24] Verma I, Madke B,Singh AL, et al. A clinico-tichological study of female androgenetic alopecia[J]. Int J Trichology , 2021,13(6) :9-16. DOI: 10. 4103/jt.jt.12. 19.
[25] Rakowska A,Slowinska M, Kowalska-Oledzka E,et al. Demmoscopy in female androgenic alopecia: method standardization and diagnostic criteria[J]. Int J Trichology , 2009, 1(2):123-130. DOI: 10. 4103/0974-7753. 58555.
[26] Suchonwanit P , Thammarucha S, Leerunyakul K. Minoxidil and its use in hair disorders: a review[J]. Drug Des Devel Ther, 2019, 13: 2777-2786. DOI: 10. 2147/DDDT.S214907.
[27]盛友渔,芮文龙,徐峰,等.外用2%及5%米诺地尔溶液治疗女性型脱发的随机对照临床研究[J].临床皮肤科杂志,2014 ,43( 10) :583-585.
Sheng YY,Rui WL, Xu F,et al. A randomized contolled clinical study on 2% and 5% topical minoxidil solution in the treatment of female pattem hair loss[J]. J Clin Dermatol, 2014, 43( 10) :583-585.
[28] Lucky AW, Piacquadio DJ, Ditre CM, et al. A randomized, placebo-controlled trial of 5% and 2% topical minoxidil solutions in the treatment of female pattern hair loss[J]. J Am Acad Dermnatol, 2004, 50 (4): 541-553. DOI: 10. 1016/j. jaad. 2003. 06. 014.
[29] Blume-Peytavi U, Hllmann K, Dietz E, et al. A randomized, single-blind trial of 5% minoxidil foam once daily versus 2% minoxidil solution twice daily in the treatment of androgenetic
alopecia in women[J]. J Am Acad Dermatol, 2011,65(6): 1126-1134.e2. DOI: 10. 1016/jaad.2010. 09. 724.
[30]叶艳婷, 曹慧,李水凤,等. 5%米诺地尔治疗33例女性型脱 发治疗前后的临床和皮肤镜观察[J].临床皮肤科杂志, 2014 ,43( 12) :739-742.
[31] Starace M,Orlando G, Alessandrini A, et al. Female androgenetic alopecia: an update on diagnosis and management [J]. AmJ Clin Dernatol, 2020,21( 1):69-84. DOI: 10. 1007/ s40257-019-00479-x.
[32]6 Kanti V, Messenger A, Dobos G, et al. Evidence-based (S3) guideline for the treatment of androgenetic alopecia in women and in men-short version[J]. J Eur Acad Dermatol Venereol, 2018 ,
32( 1):11-22. D0I: 10. 111/jdv.14624.
[ 33] Teede HIJ, Misso ML, Cotello MF, et al. Reconmendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome[ J ]. Hum Reprod,
2018 ,33( 9) :1602-1618. DOI: 10. 1093/ humrep/dey256.
[34] 张菊芳.毛发整形美容学[ M].杭州:浙江科学技术出版社, 2013:322.
[35] Fertig RM, Gamret AC, Cervantes J, et al. Microneedling for the treatment of hair loss? [ J]. J Eur Acad Dermatol V enereol, 2018,32(4) :564-569. DOI: 10. 111/jdv. 14722.
[36] Anitua E, Pino A, Martinez N, et al. The effect of plasma rich in growth factors on pattern hair loss: a pilot study [J]. Dermatol Surg,2017, 43 (5 ): 658-670. D0I: 10. 1097/DSS. 00000
000001049.
[37]中国医师协会美容与整形医师分会毛发整形美容专业委员会.中国人雄激素性脱发诊疗指南[J].中国美容整形外科杂志,2019,30( 1):前插2-前插6. DOI: 10. 3969/j. issn.1673-
7040.2019. 01.001.
[38] Price VH, Roberts JL, Hordinsky M, et al. Lack of efficacy of finasteride in postmenopausal women with androgenetic alopecia [J].J Am Acad Demnatol, 2000, 43(5 Pt 1):768-776. DOI:
10.1067/mjd.2000. 107953.
[ 39] Trieb RM. Finasteride treatment of pattemned hair loss in normoandrogenic postmenopausal women [ J ]. Dermatology , 2004 ,209( 3) :202-207. DOI: 10. 1 159/000079890.
[40] Rodrigues- Barata R, Moreno- Arrones OM, Saceda-Corralo D, et al. Low-dose oral minoxidil for female pattem hair loss: a unicenter descriptive study of 148 women[J]. Skin Appendage
Disord, 2020 ,6(3) :175-176. DOI: 10. 1159/000505820.
[41] Ramos PM, Sinclair RD, Kasprzak M, et al. Minoxidil 1 mg oral versus minoxidil 5% topical solution for the treatment of female- pattern hair loss: a randomized clinical trial[J]. J Am Acad
Dermatol, 2020, 82(1 ):252-253. D0I: 10. 1016/j. jaad. 2019. 08.060.
[42 ] Sinclair RD. Female patterm hair loss: a pilot study investigating combination therapy with low-dose oral minoxidil andspironolactone[J]. Int J Dermatol, 2018 ,57(1):104-109. DOI:
10.111/ijd. 13838.
[43] 北京中西医结合学会医学美容专业委员会,国家皮肤与免疫疾病临床医学研究中心,赵俊英,等.中西医结合诊疗雄激素性秃发专家共识[J].临床和实验医学杂志,2021,20
( 17): 1902-1905. DOI: 10. 3969/j. ssn.1671 -4695.2021.17.032.
[44] 杨顶权,刘云贞,鞠海,等.生发酊联合当归苦参丸治疗雄激素源性脱发的临床观察[J].世界中西医结合杂志,2010,5(4) :327-329, 332. DOI: 10. 3969/j. ssn.1673-6613. 2010.04.
020. Yang DQ,Liu YZ, Ju H,et al. Clinical observation of androgenetic alopecia treated with the combination of shengfa tincture and dangui kushen pills[ J]. W orld Journal of Integrated Traditional and Westem Medicine, 2010,5 ( 4): 327-329, 332. DOI: 10. 3969/j.issn. 1673-6613. 2010. 04. 020.
[45]^马凌宇,魏存会.精乌胶囊联合米诺地尔治疗雄激素源性脱 发60例临床观察[J].航空航天医学杂志,2012,23(9):1 102- 1103. DOI: 10. 3969/j.issn. 2095- 1434.2012. 09.051.
本文献转自中华整形外科杂志 2022 年 5 月第 38 卷第 5 期,不代表本网站赞同其观点和对其真实性负责,我们主要用于阅读分享,非商业用途,如若侵权,请告知删除。


