日常的医疗诊治中会遇到各种类型的创面,其中大面积深度烧伤创面及慢性难愈性创面的治疗较为棘手。应用敷料覆盖创面是一种常规治疗手段,因此创面敷料的选择及优化显得尤为重要。目前,对医用敷料的要求为不仅要能覆盖创面,还要能提供有利于创面愈合的微环境。早期的医用敷料主要以纱布、棉垫和绷带等为主,只能起到覆盖创面的作用[1];而现代医用敷料应具有止血、抗菌、抗炎、促血管化及调控创面微环境等方面的特点[2]。本文以 Van Den Bulcke 等[3] 提出的敷料制作方法为基础,首先合成了一种具有胶原特性的载药三维支架材料——甲基丙酸烯酐(MA)化明胶(GelMA),然后基于 GelMA 自身具有光敏性、高溶解性、可载药性、可降解性、低抗原性等特点,通过将 GelMA 负载银离子及重组人碱性 FGF(rh-bFGF)制备成含银+rh-bFGF 的 GelMA 水凝胶(简称复合水凝胶),最后应用该复合水凝胶对兔深Ⅱ度烧伤创面的再生修复进行实验研究,以期为临床修复皮肤及皮下软组织缺损提供一种新思路。
1 材料与方法
本实验研究遵循国家和解放军联勤保障部队第 969 医院有关实验动物管理和使用的规定。
1. 1 动物及主要试剂与仪器来源
30 只 健 康 无 特 殊 病 原 体 级 4~6 个 月 龄 、体 重 2. 5~3. 0 kg、雌雄各半日本大耳兔购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。
金黄色葡萄球菌标准菌株(ATCC 25923)购自上海艾研生物科技有限公司。氧化氘溶液购自上海子期实验设备有限公司,MA(常温下为液态)、明胶和碳酸钠以及碳酸氢钠粉末、氯化氢和氢氧化钠溶液以及纳米银(常温下为液态)购自美国 Sigma 公司 ,Irgacure2959 型 光 引 发 剂{主 要 成 分 为 2- 羟基-1-[4-(羟基乙氧基)苯基]-2-甲基-1-丙酮}购自德国 BASF 公司,Mueller Hinton 型琼脂、rh-bFGF 购自美国 Gibco 公司,Ⅱ型胶原酶购自美国 HyClone 公司,HE 染色试剂购自伊莱博生物科技(上海)有限公司。
直径为 90 mm 的灭菌培养皿购自迈博瑞生物膜技术有限公司,12-14KD 型透析袋、不同尺寸及形状的光掩膜购自广州清溢生物科技服务有限公司,S4800 型场发射扫描电子显微镜(FESEM)购自日本Olympus 公 司 ,AV-400 型 核 磁 共 振 波 谱 仪 、QUANTAX200 型 能 谱 仪 购 自 德 国 Bruker 公 司 ,Omnicure S2000 型 紫 外 光 源 购 自 加 拿 大 LumenDynamics Group 有限责任公司,Alpha 2-4 LD plus 型冷冻干燥机购于德国 Christ公司。
1. 2 GelMA 材料及 GelMA 水凝胶的合成及其最优理化特性参数的筛选
1. 2. 1 GelMA 及 GelMA 水凝胶的合成 取碳酸氢钠 14. 65 g、碳酸钠 7. 95 g 溶于 1 L 蒸馏水中,加入适量氯化氢调整 pH 值为 9. 0,再加入终质量浓度3 g/mL 的明胶后于 50 ℃恒温水浴条件下用磁力棒搅拌 1 h,直至明胶完全溶解。将前述溶液均分为3 等份,分别逐滴加入 0. 125、0. 250、0. 500 mL MA于 50 ℃恒温水浴、避光条件下用磁力棒搅拌 3 h。将 前 述 混 合 液 分 别 移 入 3 个 独 立 的 透 析 袋 中 于50 ℃恒温超纯水中透析,每 6 小时更换超纯水 1 次。1 周后将透析袋中剩余的产物(即 GelMA)移入培养皿中,于−80 ℃冰箱中冷冻 24 h 至完全冻干,然后移至冻干机内,冷冻干燥 3 d 制得冻干低浓度 GelMA材料、中浓度 GelMA 材料、高浓度 GelMA 材料。取3 种浓度冻干材料各 10 g,常温下分别溶于 100 mL双蒸水中,再分别加入终质量浓度 0. 5 g/L 光引发剂,磁力搅拌 10 min 后移至光掩膜中,暴露于 350 nm的紫外光源下 20 s 制得低浓度 GelMA 水凝胶、中浓度 GelMA 水凝胶、高浓度 GelMA 水凝胶。
1. 2. 2 GelMA 的 氢 核 磁 共 振 波 谱 测 定 取
1. 2. 1 制备好的冻干 GelMA 材料,常温下溶于氧化氘,然后采用核磁共振波谱仪检测 GelMA 的氢核磁共振波谱并采用 CAD 软件(美国 Autodesk 公司)计算波谱图的取代度。样本数为 9。
1. 2. 3 GelMA 水 凝 胶 的 表 面 形 貌 检 测 将
1. 2. 1 制备好的 GelMA 水凝胶材料置于−80 ℃冰箱冷冻 48 h,然后移至冻干机冻干 3 d 制得冻干 GelMA 水凝胶,采用 FESEM 检测其 600 倍镜下三维微观结构及孔径。样本数为 9。
1. 3 含银 GelMA 水凝胶的合成及最优参数的筛选
1. 3. 1 含 银 GelMA 水 凝 胶 的 合 成 及 其 降 解 性 测 定 根据 1. 2 筛选后的 MA 浓度,将 0. 2 mL 纳米 银于常温下溶于 1 L PBS 中,然后用移液器分别吸 取 0(不吸取)、0. 01、0. 02、0. 03、0. 04、0. 05、0. 06、0. 07、0. 08、0. 09 mL 前 述 混 合 液 ,分 别 加 至 3 mLPBS 中,再分别加入 0. 3 g 冻干 GelMA,制得含 10 种浓度纳米银的 GelMA(含银 GelMA)溶液。取含银GelMA 溶液,同 1. 2. 1 制备含银冻干 GelMA 材料备用 ;另 取 含 银 GelMA 溶 液 ,将 每 种 浓 度 的 含 银GelMA 溶 液 均 分 为 3 份(每 份 均 含 10 种 不 同 浓 度银,共 30 份样品),每份加入终质量浓度为 0. 5 g/L的光引发剂,然后将其置于光掩膜中暴露于 350 nm的紫外光源下,3 份样品的暴露时间分别为 20、25、35 s,制得 3 种不同光交联时间的含银 GelMA 水凝胶,规格均为直径 7 mm、厚度 2 mm 的圆形。
取不同光交联时间水凝胶样品,称重并记录初始质量并记为 W1。然后将其浸入 37 ℃降解液(含0. 25 mg/mLⅡ型胶原酶的 PBS)中,测定降解 12、24、36、48 h 的降解剩余率及水凝胶彻底降解所需时长。每次取出的样品,均用 PBS 冲洗后再用纸巾吸干表面水分并称重,称重并记录降解后材料的重量并记为 Wx,样品降解剩余率=Wx÷W1×100%。本实验重复 5 次。
1. 3. 2 含 银 GelMA 水 凝 胶 抗 菌 性 测 试 将 含10 种浓度银的 GelMA 水凝胶移至含金黄色葡萄球菌的琼脂培养皿表面,然后置于 37 ℃培养箱内孵育18 h,通过观察并测量培养皿内部抑菌圈直径评价含银 GelMA 水凝胶的抗菌能力,本实验重复 5 次。
1. 3. 3 含 银 GelMA 水 凝 胶 表 面 形 貌 及 银 元 素 检 测以与含最低浓度银(即不含银)GelMA 水凝胶抑菌圈直径相比有统计学意义的含银 GelMA 水凝胶为有抑菌活性。根据 1. 3. 2 的抗菌测试结果,选取有抑菌活性的且载药浓度最低的含银 GelMA水凝胶。取该含银 GelMA 水凝胶同 1. 2. 3 制得冻干含 银 GelMA 水 凝 胶 。 将 前 述 每 种 样 品 再 均 分 为 2份,1 份同 1. 2. 3 采用 FESEM 检测样品的三维微观
结构及孔径;1 份置于铝台上固定并喷金,应用能谱 仪 检 测 样 品 内 部 银 元 素 的 存 在 情 况 。 样 本 数 均为 9。
1. 3. 4 含 银 GelMA 水 凝 胶 的 溶 胀 性 测 定 取
1. 2. 3 和 1. 3. 3 中制得的冻干单纯 GelMA 水凝胶和冻干含银 GelMA 水凝胶,分别称重并记为 Wd1、Wd2,将前述 2 种冻干材料置于 37 ℃的 PBS 中浸泡 24 h,用纸巾吸干样品表面水分,分别称重并记为 WW1、WW2。溶胀率=(WW1/2−Wd1/2)÷Wd1/2×100%,根据 2 种水凝胶的溶胀率计算结果,分析银离子的加入对材料溶胀性的影响,本实验重复 5 次。
1. 4 复合水凝胶的合成及其形貌观察
1. 4. 1 复合水凝胶的合成 根据本研究团队预实验探讨的 rh-bFGF 在 GelMA 水凝胶含量的预实验结果(另文发表)及前述实验结果 ,取冻干 GelMA0. 12 g,于常温下溶解于 1. 2 mL PBS 中,然后依次加入 0. 000 06 g 光 引 发 剂 、0. 125 mL rh-bFGF 溶 液 、0. 03 mL 纳米银溶液混合均匀,然后将其置于光掩膜中暴露于 350 nm 的紫外光源下 25 s,即可制得负载银和 rh-bFGF 的 GelMA 水凝胶,即为复合水凝胶。大体观察复合水凝胶的外观,并将其置于预先裁剪的与水凝胶尺寸相当的单层纱布上,再置于无纺布敷料上,在复合水凝胶的表面覆盖隔离纸后独立包装于无菌袋内低温(4 ℃)保存备用。
1. 4. 2 复 合 水 凝 胶 的 表 面 形 貌 检 测 同
1. 2. 3 将复合水凝胶制作成冻干材料,采用 FESEM于 200 倍下观察其三维微观结构及其与含银 GelMA的三维观结构(另文发表)差异(确认 rh-bFGF 是否成功引入)与孔径。样本数为 9。
1. 5 复合水凝胶对兔深Ⅱ度烧伤创面的影响
1. 5. 1 兔深Ⅱ度烧伤模型的制备 取 30 只兔,按照 30 mg/kg 的剂量,于兔耳缘静脉注射 10 mg/mL戊巴比妥钠进行麻醉。以脊柱为中心在背部剃除10 cm×10 cm 面积的毛发。将直径 20 mm、重 100 g的圆柱体铁块置于沸水中预热 10 min 使其温度上升至 98~100 ℃,先后置于兔背两侧间隔 3 cm 的剃毛皮肤区停留 15 s 造成深Ⅱ度烧伤创面(经病理切片证实)。采用 Meeh-Rubner 公式[4] 计算兔深Ⅱ度烧伤面积为 0. 95%~1. 30%TBSA,远小于补液指标(30%TBSA),因此直接采用碘伏消毒+生理盐水冲洗创面。以兔头侧为基准,脊柱左侧创面纳入复合水凝胶组,右侧创面纳入纱布对照组,复合水凝胶组创面应用复合水凝胶覆盖,纱布对照组创面应用4 cm×3 cm 的单层纱布覆盖;然后 2 组创面均用无纺布包扎。后续每 48 小时对创面进行消毒处理及敷料更换。
1. 5. 2 创面愈合情况 伤后 3、
7、14、21、28 d 观 察 2 组兔创面愈合情况;通过标准坐标纸拓模精确计算伤后 7、14、21、28 d 创面愈合面积并计算其愈合率,创面愈合率=(伤后即刻创面面积−未愈合创面面积)÷伤后即刻创面面积×100%。样本数为 30。
1. 6 统计学处理
采用 SPSS 22. 0 统计软件进行数据处理。符合正态分布的计量资料数据以 xˉ ± s 表示,多个样本间总体比较采用重复测量方差分析或单因素方差分析,组间两两比较采用独立样本 t 检验。P<0. 05 为差异有统计学意义。
2 结果
2. 1 GelMA 材料及 GelMA 水凝胶理化特性
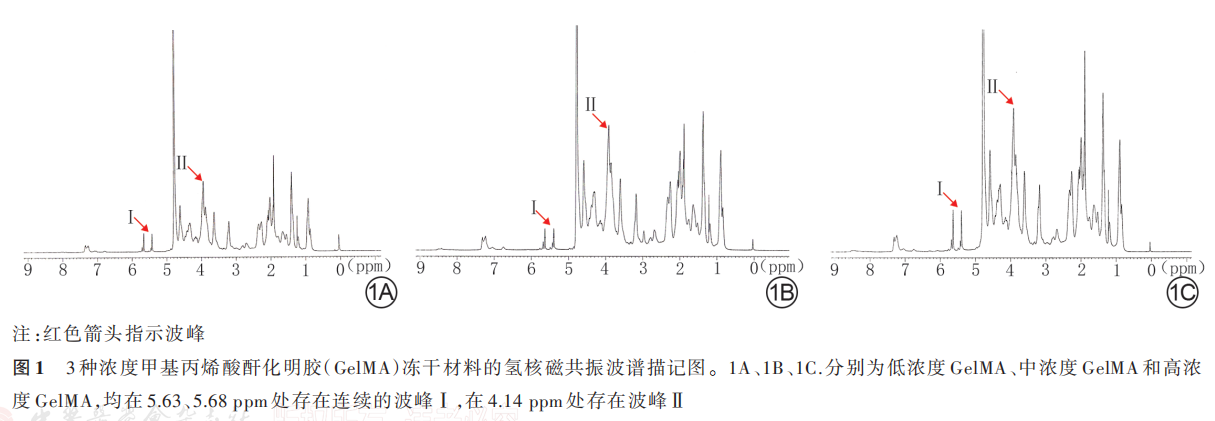
2. 1. 1 GelMA 的 氢 核 磁 共 振 波 谱 低 浓 度 GelMA 材料、中浓度 GelMA、高浓度 GelMA 材料均在 5. 63、5. 68 ppm 处 存 在 连 续 的 波 峰 Ⅰ ,同 时 在4. 14 ppm 处存在波峰Ⅱ。低浓度 GelMA 材料、中浓度 GelMA 材料及高浓度 GelMA 材料的取代度分别为(22. 3±1. 7)%、(36. 2±1. 8)%和(66. 3±1. 5)%,总体比较差异有统计学意义(F=1 628. 00,P<0. 001),即 3 种材料具有不同的取代度。见图 1。
2. 1. 2 GelMA 水 凝 胶 的 表 面 形 貌低 浓 度GelMA水 凝 胶 存 在 疏 松、不 规 则 三 维 空 间 网 状 结构,孔 隙 层 次 不 均 匀,孔 径 为(60±17)μm;中 浓 度GelMA 水凝胶三维空间网络、孔径大小均较均匀规则,孔径为(45±13)μm;高浓度 GelMA 水凝胶支架三维空间网状结构致密、层次混乱,局部区域可见不规则圆孔平铺结构,孔径为(25±15)μm。3 种浓度 GelMA 水凝胶的孔径大小差异明显(F=12. 20,P<0. 001)。见图 2。选取(MA)中浓度作为后续材料制作浓度。

2. 2 含银 GelMA 水凝胶各项参数
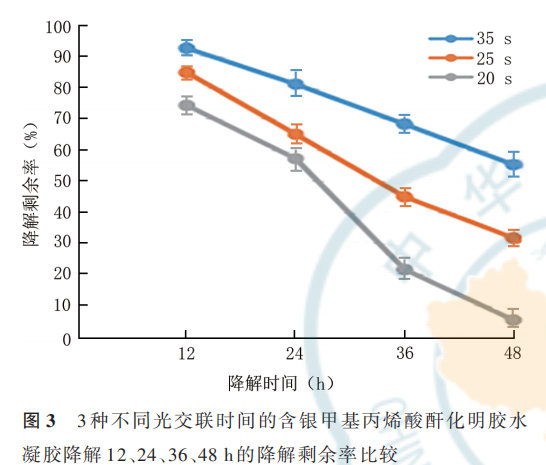
2. 2. 1 含银 GelMA 水凝胶的降解性 相同光交联时间下含不同浓度银 GelMA 水凝胶的降解性基本一致。20、25、35 s 光交联时间的含银 GelMA 水凝胶降解 12、24、36、48 h 的降解剩余率见图 3;20、25、35 s 交联时间的含银 GelMA 水凝胶彻底降解所需时间 依 次 为(50. 2±2. 4)、(62. 4±1. 4)、(72. 2±3. 2)h,总 体 比 较 ,差 异 有 统 计 学 意 义(F=182. 40,P<0. 001)。选取 25 s 作为后续光交联时间。
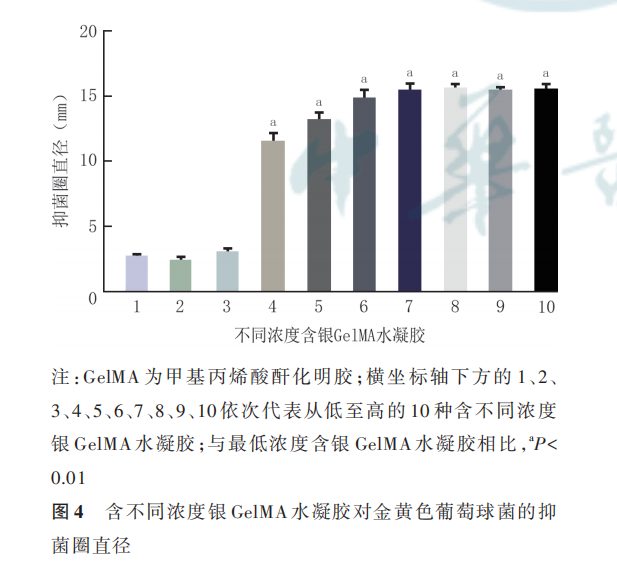
2. 2. 2 含银 GelMA 水凝胶的抗菌性 低浓度至高浓度的 10 种含银 GelMA 水凝胶对金黄色葡萄球菌的抑菌圈直径基本呈浓度依赖性升高趋势,总体比较差异明显(F=428. 70,P<0. 001)。与含最低浓度银 GelMA 水凝胶相比,其他有抑菌活性的含低浓度至高浓度银 GelMA 水凝胶的抑菌圈直径均明显增 大(t 值 分 别 为 26. 35、33. 84、43. 65、42. 17、49. 24、55. 74、43. 72,P<0. 001)。对金黄色葡萄球菌抑菌圈直径为(12. 1±0. 7)mm 的含银 GelMA 水凝胶具有抑菌活性且载药浓度最低,选取该含银浓度为后续材料制作的浓度。见图 4。
2. 2. 3 含 银 GelMA 水 凝 胶 表 面 形 貌 及 元 素 检 测含银 GelMA 水凝胶的微观形貌为规律的趋于平行线性的条索状结构,孔径为(45±13)μm,且含有银元素,见图 5。

2. 2. 4 含银 GelMA 水凝胶及单纯 GelMA 水凝胶的溶胀率浸润24h,含银GelMA 水凝胶的溶胀率为(16. 9±0.7)%,与GelMA水凝胶的(16. 4±0. 5)%相近(t=1. 74,P=0. 100),即银离子溶液的加入不会改变 GelMA 水凝胶的溶胀性。
2. 3 复合水凝胶的外观与微观形貌
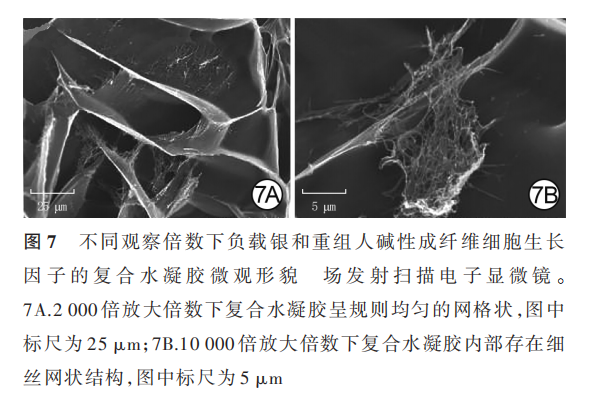
复合水凝胶呈无色清亮透明状且具有一定的黏弹性,见图 6。复合水凝胶的三维微观结构为规则、均匀的网格状,其内部存在细丝网状结构,为rh-bFGF 材料负载于含银 GelMA 所致;孔径为(40±21)μm,见图 7。

2. 4 复合水凝胶对兔深Ⅱ度烧伤创面的影响
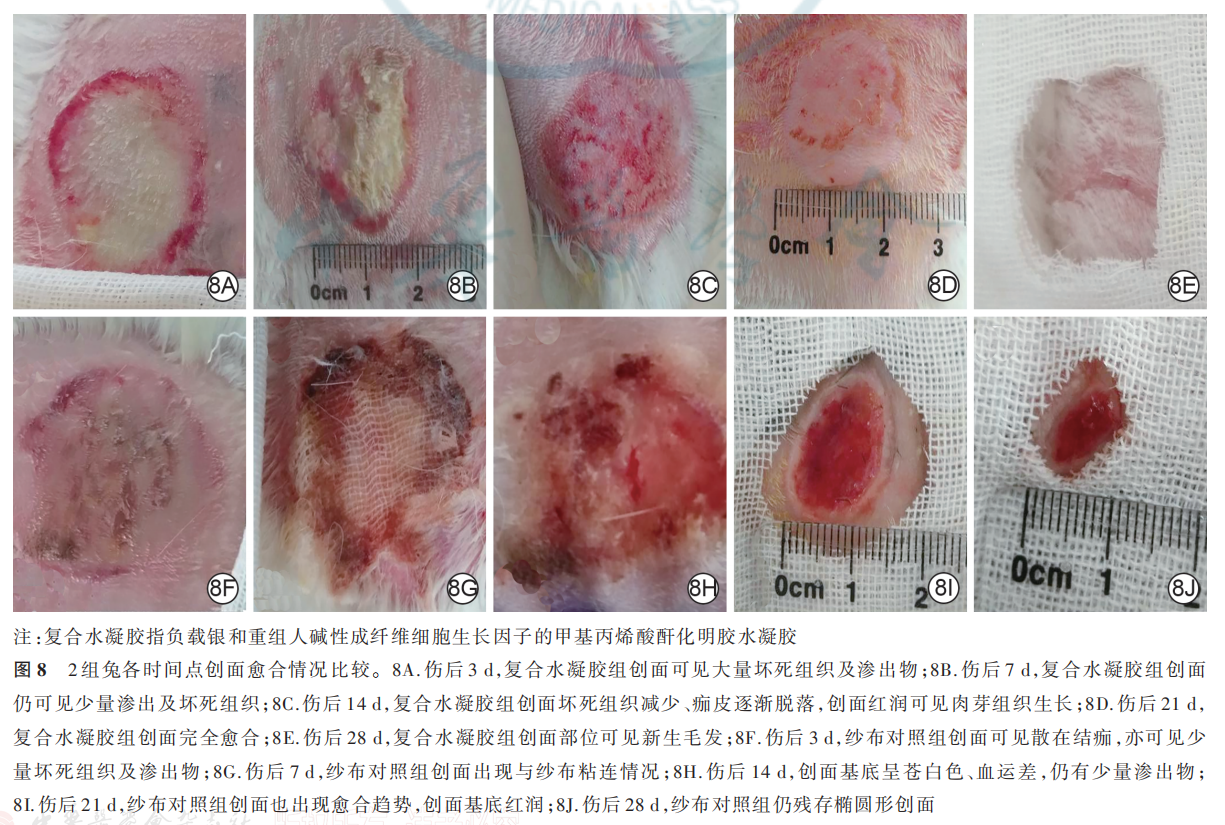
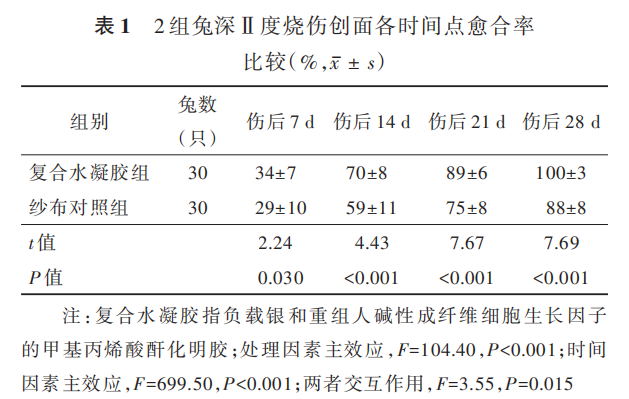
伤后 3 d,复合水凝胶组兔创面可见大量坏死组织及渗出物;纱布对照组兔创面可见散在结痂,可见少量坏死组织及渗出物。伤后 7 d,复合水凝胶组兔创面已明显缩小,局部仍可见少量渗出及坏死组织;纱布对照组兔创面出现与纱布粘连情况。伤后14 d,复合水凝胶组兔创面坏死组织减少、痂皮逐渐脱落,创面红润可见肉芽组织生长;纱布对照组兔创面中粘连的纱布自行脱落,创面基底呈苍白色、血运差,仍有少量渗出物。伤后 21 d,复合水凝胶组兔创面完全愈合;纱布对照组兔创面也出现愈合趋势,创面基底红润,创缘上皮向中央爬行生长。伤后 28 d,复合水凝胶组兔创面部位可见新生毛发,纱布对照组兔仍残存椭圆形创面。见图 8。伤后 7、14、21、28 d,复合水凝胶组兔创面愈合率均明显大于纱布对照组(P<0. 05 或 P<0. 01),见表 1。
3 讨论
ECM 可为细胞的增殖、迁移、分化等生物学活动提供良好微环境,仿生 ECM结构的功能材料可以增强细胞生物活性进而促进创面愈合。GelMA 水凝胶已被证实具有良好的ECM 特性[5],但 GelMA材料自身的硬度及活性均由其取代度来决定,即筛选合适取代度的 GelMA 材料是本实验的基础,本研究选取了三维结构规则均匀的中浓度 GelMA 材料作为研究参数。目前 GelMA 水凝胶及其三维支架在与临床相关工程中的应用已经得到了广泛报道,如骨组织工程、心脏工程和血管组织工程等[6⁃7]。创面若存在感染易导致愈合延迟[8],而含银离子的非抗生素化合物具有抗菌作用,且可以降低微生物耐药性[9⁃10]。GelMA 水凝胶自身携带负电荷[11],银离子带正电荷,因此含银 GelMA 水凝胶具有良好的稳定性,将其应用于创面有利于银离子发挥持续抑菌作用。本研究合成的含银 GelMA 水凝胶应用临床常见的金黄色葡萄球菌作为测试菌,并筛选出了具有抑菌活性且载药浓度最低的含银 GelMA 水凝胶。此外,水凝胶的降解性也会影响其促创面愈合作用,而紫外光的交联时间会影响 GelMA 材料的降解性,本研究筛选出的紫外光最佳交联时间为 25 s。
慢性难愈性创面是目前医疗工作中面临的难题,患者常伴严重的基础疾病或自身营养状况差,创面易感染且创周多存在微循环障碍[12⁃15]。慢性难愈性创面修复方案主要为常规换药和应用人工敷料、生长因子、富血小板血浆、负压治疗及皮片、皮瓣、肌瓣、肌皮瓣移植等[16⁃19]。本研究通过组织工程技术,在 GelMA 水凝胶支架中负载银+rh-bFGF,使复合水凝胶不但可以作为良好的创面敷料而且具备抗感染和促进创面上皮化的能力。同时,该复合水凝胶具有光敏性便于塑形,可根据创面形状进行个性化治疗。本研究中的复合水凝胶经 FESEM 观察,可见其微观结构的内部还存在细丝网状结构,这与陈秋东[20] 观察到的结果一致。相较于 Subraveti和 Raghavan 等[21] 提出的明胶“皮肤”保持方式,本研究中的复合水凝胶采用无菌密封后置于−4 ℃冰箱保存较简单、便捷。
GelMA 水凝胶促进创面愈合的作用,可能与其三维支架可加速血管形成有关。具有递送生物活性成分的水凝胶敷料,已经被证实较常规水凝胶敷料 或 单 纯 在 创 面 部 位 注 射 简 单 肽 溶 液 更 为 有效[22⁃26]。本研究中的复合水凝胶是一种负载非细胞型水凝胶敷料,其具有如下优点:(1)有一定的黏弹性,可温和黏附在周围皮肤和创面软组织,更换敷料时不破坏创面及其中的新生组织和血管。(2)外层无纺布可防水且密封创面,避免水凝胶敷料干燥,为创面提供良好的愈合环境,且无纺布可吸收创面渗出的组织液和血液。(3)敷料在换药周期内可部分或完全降解,释放的活化银离子可对抗创面内致病原;敷料降解产物可补充创面胶原含量,减轻炎症反应。(4)相关研究显示类似的自制复合水凝胶敷料内部富含精氨酸-甘氨酸-天门冬氨酸基序[27]、基质金属蛋白酶序列[28]和 rh-bFGF 等成分,提供了创面修复的生长因素,促进了创面愈合,降低了创面感染[29⁃32] 。(5)具有紫外光诱导交联变性的特性,可通过设计光掩膜的形状来制备各种形状的敷料,如圆形、方形、梭形等,用于创缘不规则的创面,从而实现创面的个体化精准医疗。
本实验为阶段性探索实验,受实验条件及课题经费等限制,有些科学问题没有进行深入研究,如本研究只设了纱布对照组,没有设标准治疗对照组等 影 响 了 数 据 结 果 的 完 整 性 ;也 未 对 银 离 子 或rh-bFGF 导入 GelMA 溶液后药物的释放问题[33] 进行深入研究,以上均有待后续研究完善。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明
陈向军:研究设计、实施与论文撰写;吴兴、林欢欢、刘肇兴、刘沙:实验实施与资料收集
参考文献
[1] Pereira RF, Bártolo PJ. Traditional therapies for skin wound healing [J]. Adv Wound Care (New Rochelle), 2016, 5(5): 208 -229 . DOI : 10.1089/wound.2013.0506.
[2] 罗高兴, 刘梦龙 . 应用功能材料促进皮肤创面修复[J].中华烧伤 杂 志 , 2021, 37(11):1005-1010. DOI: 10.3760/cma. j.cn501120-20210930-00340.
[3] Van Den Bulcke AI, Bogdanov B, De Rooze N, et al. Structuraland rheological properties of methacrylamide modified gelatinhydrogels[J]. Biomacromolecules, 2000,1(1):31-38. DOI: 10.1021/bm990017d.
[4] Ohwada K. Body surface area of the golden Syrian hamster[J].Jikken Dobutsu, 1992,41(2):221-224. DO I: 10.1538/expanim1978.41.2_221.
[5] 胥杰龙 .改性明胶/聚丙烯酰胺复合水凝胶及其用于软骨缺损修复的研究[D].成都:西南交通大学,2016.
[6] Yue K, Trujillo-de Santiago G, Alvarez MM, et al. Synthesis,properties, and biomedical applications of gelatin methacryloyl(GelMA) hydrogels[J]. Biomaterials, 2015, 73: 254-271. DOI:10.1016/j.biomaterials.2015.08.045.
[7] Bessa LJ, Fazii P, Di Giulio M, et al. Bacterial isolates frominfected wounds and their antibiotic susceptibility pattern: someremarks about wound infection[J]. Int Wound J, 2015, 12(1):47-52. DOI: 10.1111/iwj.12049.
[8] Lok CN, Ho CM, Chen R, et al. Silver nanoparticles: partialoxidation and antibacterial activities[J]. J Biol Inorg Chem, 2007,12(4):527-534. DOI: 10.1007/s00775-007-0208-z.
[9] 董云青, 李琳琳, 朱宣儒, 等 . 含银黏性水凝胶的制备及其在小鼠细菌定植全层皮肤缺损创面愈合中的作用[J]. 中华烧伤杂 志 , 2021, 37(11): 1036-1047. DOI: 10.3760/cma. j.cn501120-20210906-00304.
[10] Xu R, Luo G, Xia H, et al. Novel bilayer wound dressing composed of silicone rubber with particular micropores enhanced wound re-epithelialization and contraction[J]. Biomaterials, 2015,40:1-11. DOI: 10.1016/j.biomaterials. 2014.10.077.
[11] Xavier Mendes A, Moraes Silva S, O'Connell CD, et al.Enhanced electroactivity, mechanical properties, and printabilitythrough the addition of graphene oxide to photo-cross-linkablegelatin methacryloyl hydrogel[J]. ACS Biomater Sci Eng, 2021,7(6):2279-2295. DOI: 10.1021/acsbiomaterials.0c01734.
[12] Armato U,Freddi G.Editorial: biomaterials for skin wound repair: tissue engineering, guided regeneration, and wound scarring prevention[J]. Front Bioeng Biotechnol, 2021, 9: 722327. DOI: 10.3389/fbioe.2021.722327.
[13] Xiao Y, Reis LA, Feric N, et al. Diabetic wound regenerationusing peptide-modified hydrogels to target re-epithelialization[J]. Proc Natl Acad Sci U S A, 2016, 113(40): E5792-E5801.DOI: 10.1073/pnas.1612277113.
[14] Eke G, Mangir N, Hasirci N, et al. Development of a UV crosslinked biodegradable hydrogel containing adipose derived stem cells to promote vascularization for skin wounds and tissue engineering[J]. Biomaterials, 2017,129:188-198. DOI: 10.1016/j. biomaterials.2017.03.021.
[15] Zhao X, Sun X, Yildirimer L, et al. Cell infiltrative hydrogel fibrous scaffolds for accelerated wound healing [J ]. Acta Biomater, 2017,49:66 -77. DOI: 10.1016/j.actbio.2016.11 .017.
[16] 宋知仁, 郑建锋, 成路, 等 . 同型新鲜冰冻血浆联合负压封闭引 流 在 压 疮 修 复 中 的 效 果 [J]. 中 华 烧 伤 杂 志,2017, 33(3):171-172. DOI: 10.3760/cma.j.issn.1009-2587.2017.03.009.
[17] Samani MK, Saberi BV, Ali Tabatabaei SM, et al. The clinicalevaluation of platelet-rich plasma on free gingival graft's donorsite wound healing[J]. Eur J Dent, 2017, 11(4): 447-454. DOI:10.4103/ejd.ejd_76_17.
[18] Sridharan K, Sivaramakrishnan G. Growth factors for diabetic foot ulcers: mixed treatment comparison analysis of randomized clinical trials[J]. Br J Clin Pharmacol, 2018,84(3):434 -444. DOI: 10.1111/bcp.13470.
[19] 中国老年医学学会烧创伤分会 . 胶原类创面材料临床应用全国专家共识(2018 版)[J]. 感染、炎症、修复,2018,19(4):200-203.DOI: 10.3969/j.issn.1672-8521.2018.04.002.
[20] 陈秋东 .中等纯度重组人表皮生长因子(rhEGF)的分离纯化及在美容产品中的应用[D].杭州:浙江大学,2003.
[21] Subraveti SN, Raghavan SR. A simple way to synthesize a protective "skin" around any hydrogel [J]. ACS Appl Mater Interfaces, 2021, 13(31): 37645 -37654. DO I : 10.1021/acsami.
[22] Ko H, Suthiwanich K, Mary H, et al. A simple layer-stacking technique to generate biomolecular and mechanical gradients in photocrosslinkable hydrogels [J]. Biofabrication , 2019, 11(2): 025014. DOI: 10.1088/1758 -5090/ab
[23] Sun X, Lang Q, Zhang H, et al. Cell scaffolds: electrospun photocrosslinkable hydrogel fibrous scaffolds for rapid in vivo vascularized skin flap regeneration[J]. Adv Funct Mater, 2017, 27(2).DOI:10.1002/adfm.201770008
[24] Jannasch M, Groeber F, Brattig NW, et al. Development andapplication of three-dimensional skin equivalents for theinvestigation of percutaneous worm invasion[J]. Exp Parasitol,2015,150:22-30.DOI: 10 .1016 /j .exppara.2015.01.005.
[25] Wu J , Zhu J, He C, et al . Comparative study of heparinpoloxamer hydrogel modified bFGF and aFGF for in vivo wound healing efficiency [J]. ACS Appl Mater Interfaces , 2016, 8(29): 18710 -18721. DOI :10 .1021/acsami.6b06047.
[26] Zhao L, Li X, Zhao J, et al. A novel smart injectable hydrogel prepared by microbial transglutaminase and human-like collagen: its characterization and biocompatibility[J]. Mater Sci Eng C Mater Biol Appl, 2016, 68: 317-326. DOI: 10.1016/j. msec.2016.05.108.
[27]Liu M, Luo G, Wang Y, et al. Optimization and integration of nanosilver on polycaprolactone nanofibrous mesh for bacterial inhibition and wound healing in vitro and in vivo[J]. Int J Nanomedicine , 2017 ,12 : 6827 -6840. DOI: 10.2147/IJN . S140648 .
[28] Liu Y , Chan-Park MB . A biomimetic hydrogel based on methacrylated dextran - graft -lysine and gelatin for 3 D smooth muscle cell culture[J]. Biomaterials, 2010, 31(6): 1158 -1170. DOI: 10.1016/j.biomaterials.2009.10.040.
[29] Huang R, Hu J, Qian W, et al. Recent advances in nanotherapeutics for the treatment of burn wounds [J]. Burns Trauma , 2021,9:tkab026[2022 -04-02]. https://pubmed. ncbi .nlm.nih. gov/ 34778468/.DOI: 10.1093/burnst/tkab026.
[30] Zhang X, Shu W, Yu Q, et al. Functional biomaterials for treatment of chronic wound[J]. Front Bioeng Biotechnol, 2020,8: 516. DOI: 10.3389/fbioe.2020.00516.
[31] Chen G, Yu Y, Wu X, et al. Wound healing: bioinspired multifunctional hybrid hydrogel promotes wound healing[J/OL]. Adv Funct Mater, 2021, 28(33): 1870233[2021-09-30]. https:// doi. org/10.1002/adfm. 202105749. DOI: 10.1002/adfm. 20187 0233.
[32]焦建强, 李烨, 黄喆, 等 . 重组人表皮生长因子凝胶联合纳米银敷料对烧伤后瘢痕的影响[J].中国组织工程研究,2015,(25): 4007-4011. DOI: 10.3969/j.issn.2095-4344.2015.25.014.
[33] Kamaly N, Yameen B, Wu J, et al. Degradable controllerelease polymers and polymeric nanoparticles: mechanisms of controlling drug release[J]. Chem Rev, 2016, 116(4): 2602 -2663. DOI: 10.1021/acs.chemrev.5b00346.
本文献包括图片转载于中华烧伤与创面修复杂志 2022 年 7 月第 38 卷第 7 期,不代表本公众号赞同其观点和对其真实性负责。我们用于阅读分享,非商业用途,如若侵权,请告知删除。



