皮肤创面修复需要多种细胞参与、协作[1⁃3]。创面修复失调将会诱发多种健康问题,甚至危及生命。例如,糖尿病患者足部创面经久不愈,病原菌入侵引发溃疡,最终发展成糖尿病足,可能引发全身感染导致严重后果[4⁃5];而创面处细胞过度增殖,则会促使瘢痕过度增生或发展为瘢痕疙瘩,影响机体活动和美观,给患者带来巨大痛苦[6⁃7]。
细胞间通信依赖于多种生长因子交互的信号 网 络[8⁃9]。 EGF、血小板衍生生长因 子PDGF)、VEGF、FGF 等在创面修复中扮演着重要角色[10⁃12],例 如 ,已 有将 多个 FGF 家族因子(FGF1、FGF2、FGF7、FGF10)相关药物用于创面治疗的临床试验[13⁃15]。FGF 的过度表达也与癌症的发生发展密切相关[16]。因此,揭开生长因子内在复杂的调控网络,有助于开发生长因子相关疗法促进创面修复。
真皮层的胶原沉积和成功重塑是创面修复完成和保障新生皮肤功能的基础[17⁃18]。据文献报道,真皮 Fb(dFb)具有高异质性和多向分化潜能[19⁃21],虽然 已 有 多 篇 文 献 探 讨 了 dFb 的 亚 群 组 成 和 变化[22⁃23],但鲜有文献报道创面愈合过程中各 dFb 亚群之间的通信。因此,鉴于生长因子在创面修复中的重要潜能,本研究基于单细胞 RNA 测序技术全面分析和探讨皮肤创面愈合过程中 dFb 的异质性及其与多种生长因子信号网络的内在联系。
1 材料与方法
本实验研究经厦门大学动物护理和使用委员会批准,批号:XMULAC20190090。1. 1 动物及主要试剂和仪器来源 12 只 8 周 龄 雄 性 无 特 殊 病 原 体(SPF)级健康C57BL/6 小鼠,体重约 20 g,购自厦门大学实验动物中心,许可证号:SYXK(闽)2018-0009。胶原酶 D 购自瑞士罗氏公司,牛血清白蛋白(BSA)、Hank 平衡盐溶液和 DNA 酶Ⅰ购自北京索莱宝科技有限公司,死细胞去除试剂盒购自德国美天旎公司,红细胞裂解 液 购 自 天 根 生 化 科 技(北 京)有 限 公 司 ,高 糖DMEM 培养基、多聚甲醛、OCT 包埋剂(聚乙二醇和聚乙烯醇的水溶性混合物)、含 4',6-二脒基-2-苯基吲哚(DAPI)封片剂购自美国赛默飞世尔科技公司,皂苷购自德国默克公司,兔抗小鼠 FGF7 抗体购自武汉爱博泰克生物科技有限公司,大鼠抗小鼠干细胞 抗 原 1(SCA1)抗 体 、山 羊 抗 小 鼠 二 肽 基 肽 酶4(DPP4)抗体、山羊抗小鼠 PDGF 受体 α(PDGFRα)抗体均购自美国 R&D Systems 公司,异硫氰酸荧光素(FITC)标记的小鼠源性平滑肌肌动蛋白(SMA)抗体(使用时不需要添加二抗)购自美国 BioLegend公司,花青素 3 标记的驴抗兔 IgG 抗体、FITC 标记的驴抗山羊 IgG 抗体、花青素 5 标记的驴抗大鼠和驴抗山羊 IgG 抗体均购自美国 Jackson Immuno Research公司。蔡司 880 型激光扫描共聚焦显微镜购自德国蔡司公司。
1. 2 创面模型建立
取 6 只 C57BL/6 小鼠,用体积分数 3% 异氟烷吸入麻醉(术中维持),常规剃去背部毛发,于背部两侧各画出 1 个 1. 0 cm×0. 5 cm 大小的长方形区域,用消毒的手术剪把该区域全层皮肤剪下,造成全层皮肤缺损。术后,于 SPF 级环境中饲养小鼠1. 3 组织细胞悬液制备[24]伤后 7 d,颈椎脱臼处死 5 只全层皮肤缺损小鼠并取其创面组织;另取 5 只 C57BL/6 小鼠,颈椎脱臼处死后取其正常皮肤组织。分别在 Hank 平衡盐溶液中将 2 种组织尽量切成小块,加入 2. 5 mg/mL 胶原酶 D 和 30 ng/mL DNA 酶Ⅰ,放入摇床中,于 37 ℃以 70 r/min 转速消化 2 h。将细胞混合液用孔径为30 μm 过滤器过滤,除去未消化的大组织块和毛发等杂质。以 300×g 离心后弃去上清液,加入红细胞裂 解 液 并 吹 散 细 胞 ,反 应 2 min,加 入 含 体 积 分 数10% 胎牛血清的高糖 DMEM 培养基终止反应,离心获得细胞悬液用于后续实验。
1. 4 单细胞 RNA 文库构建、测序和数据处理取 1. 3 中获得的 2 种组织细胞悬液,使用死细胞去除试剂盒去除死细胞后,交由广州基迪奥生物科技有限公司进行单细胞 RNA 文库的构建、高通量测序和生物信息学分析,基本流程如下。将样品加载到 10x Genomics 平台的胶珠微滴扩增系统中,生成油滴包裹的单细胞凝胶珠,使用 10x Genomics 单细胞建库试剂盒依次进行反转录合成互补 DNA、DNA 酶切及添加测序接头、PCR 扩增等,获得测序文库,采用 Illumina Novaseq6000 测序仪进行单细胞DNA 测序。使用 Cell Ranger 3. 0. 2 pipiline 软件,将原始测序数据解构并与 UCSC 数据库中的小鼠参考基 因 组 mm10-1. 2. 0 配 对 。 使 用 R4. 1. 1 软 件 的Seurat 3. 0 程序对原始测序数据进行无监督聚类获得基因表达矩阵。采用二维 tSNE 云图对 2 种组织细胞的基因表达进行可视化展示,包括按细胞群分类,按细胞来源分类,按标记 dFb 的 PDGFRα 基因、标 记 脉 管 内 皮 细 胞 的 血 小 板 内 皮 细 胞 黏 附 分 子1(PECAM1)基 因 和 淋 巴 管 内 皮 透 明 质 酸 受 体1(LYVE1)基因、标记免疫细胞的受体型蛋白酪氨酸磷酸酶 C(PTPRC)基因以及标记 KC 的角蛋白 10 基因和角蛋白 79 基因分类。
1. 5 各细胞群基因表达情况与细胞定义
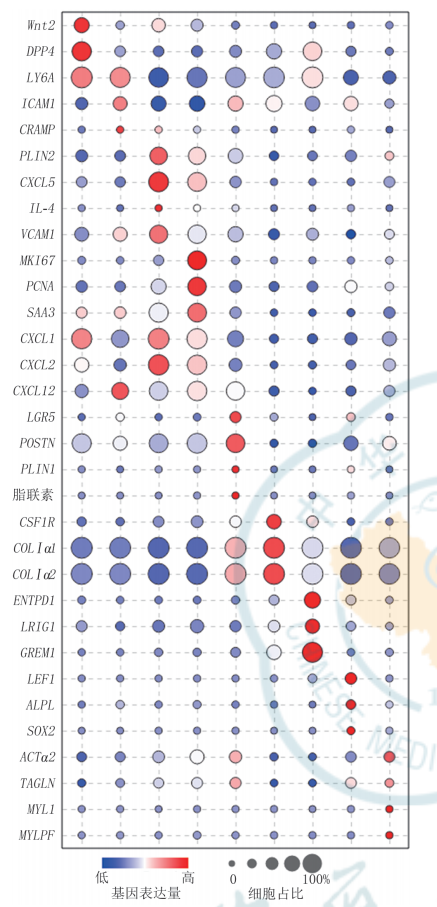
根据已有文献报道和 CellMarker 数据库(http://bio-bigdata. hrbmu. edu. cn/CellMarker/)检 索[25] 情况,分析 2 种组织细胞的基因表达矩阵中标志基因表达情况,对各细胞群进行编号和定义。将测序后获 得 的 基 因 表 达 数 据 导 入 GraphPad Prims 9 软 件中,用气泡图展示 dFb 群的标志基因表达情况,用热图展示非 dFb 群的标志基因表达情况。
1. 6 细胞间通信网络分析[26]
将 1. 4 获得的基因表达矩阵和 1. 5 获得的细胞分群信息导入 R4. 1. 1 软件的 CellChat 1. 1. 3 程序,对细胞间通信进行分析。通过网络图分别展示 2 种组织中细胞间通信情况,通过热图展示创面组织中细胞间通信强度,进一步通过网络图展示创面组织中通信强度最强的 3 个细胞群分别与其他各细胞群的 通 信 情 况 。 采 用 热 图 展 示 创 面 组 织 的 VEGF、PDGF、EGF、FGF 信号通路中细胞间通信情况。
采用相对贡献图分别展示 2 种组织中 FGF 的各亚型与 FGF 受体(FGFR)各亚型的两两配对(以下简称 FGF 配受体对)在 FGF 信号网络中的贡献(仅展示 P<0. 05 的 FGF 配受体对)。进一步通过网络图展示 2 种组织中相对贡献排名前 2 的 FGF 配受体对信号通路中的细胞间通信。
1. 7 多重免疫荧光染色分析 FGF7 蛋白表达与分布及其与另外 4 种 dFb 标志蛋白的共定位
同 1. 3 取 1 只全层皮肤缺损小鼠伤后 7 d 的创面组织及 1 只健康小鼠的正常皮肤组织,分别展平并浸没在 OCT 包埋液中,于−20 ℃冰冻成型后,以15~20 μm的厚度切片。用40 g/L多聚甲醛固定15 min,10 g/L 皂苷通透化 10 min,在 50 g/L BSA 中封闭 1 h。然后分别加入一抗兔抗小鼠 FGF7 抗体(稀释比为1∶100)与山羊抗小鼠 DPP4 抗体(稀释比为 1∶200)及大鼠抗小鼠 SCA1 抗体(稀释比为 1∶400)共孵育,或是兔抗小鼠 FGF7 抗体(稀释比为 1∶100)与山羊抗小鼠 PDGFRα 抗体(稀释比为 1∶100)及 FITC 标记的小鼠源性 SMA 抗体(稀释比为 1∶200)共孵育,4 ℃孵育 6 h。加入二抗花青素 3 标记的驴抗兔 IgG 抗体与 FITC 标记的驴抗山羊 IgG 抗体和花青素 5 标记的驴抗大鼠 IgG 抗体(稀释比均为 1∶250),或是花青素3 标记的驴抗兔 IgG 抗体和花青素 5 标记的驴抗山羊 IgG 抗体(稀释比均为 1∶250),4 ℃孵育 4 h。加入含 DAPI 的封片剂,于 200 倍激光扫描共聚焦显微镜下,观察 FGF7 蛋白(阳性染色为红色)的表达和分布以及其与标记间质祖细胞的 DPP4(阳性染色为绿色)和 SCA1(阳性染色为蓝紫色)、标记肌 Fb 和血管平滑肌细胞的 SMA(阳性染色为绿色)、标记 dFb 的PDGFRα(阳性染色为蓝紫色)的蛋白的共定位表达情况。
2 结果
2. 1 细胞组成
二维 tSNE 云图显示,健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后 7 d 创面组织中均包含 25 个细胞群,但 2 种组织中各细胞群中细胞数不一致,见图 1。PDGFRα、PECAM1、LYVE1、PTPRC 基因及角蛋白 10 和角蛋白 79 基因在二维 tSNE 云图上均有各自 明 确 的 分 布 ,分 别 指 示 特 定 的 细 胞 群 ;表 达PDGFRα 的 细 胞 群 较 多 ,有 9 个 ,均 为 dFb 亚 群 。见图 2。
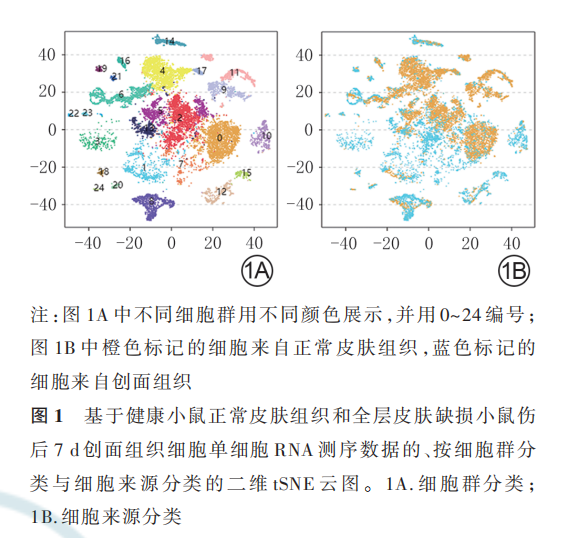
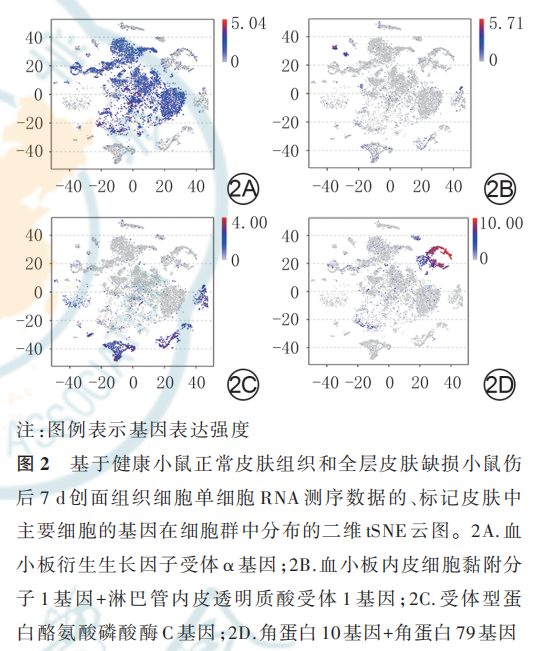
2. 2 细胞定义和 dFb 亚群的划分
对 2. 1 中 25 个细胞群按 C0~C24 编号,分为 9 个dFb 亚群和 16 个非 dFb 群进行定义。dFb 亚群中,C0 为间质祖细胞,C1 为增殖和炎症相关细胞,C2 为肌 Fb 相关 Fb,C4 为 ECM 沉积相关细胞,C5 为脂肪前体细胞,C6 为毛囊乳头细胞,C7 为定向脂肪细胞,C13 为具有收缩能力的肌肉细胞相关 Fb,C17 为乳头层细胞。dFb 亚群标志基因表达情况见图 3。非 dFb 群中,C3 为中性粒细胞,C8 为 T 细胞,C9 和C11 为 KC 的 2 个亚群,C10 为巨噬细胞,C12 为朗格罕细胞 ,C14 为周细胞 ,C15 为浆细胞样树突状细胞 ,C16 为 施 万 细 胞 等 神 经 细 胞 ,C18 为 红 细 胞 ,C19 为血管内皮细胞,C20 为自然杀伤细胞,C21 为淋巴管内皮细胞 ,C22 为肥大细胞 ,C23 为黑素细胞,C24 为血管平滑肌细胞。非 dFb 群标志基因表达情况见图 4。

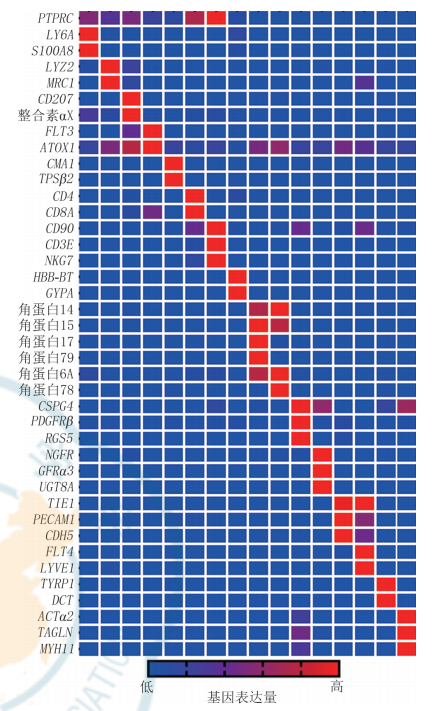

2. 3 细胞间通信
网络图显示,与健康小鼠正常皮肤组织比较,全层皮肤缺损小鼠伤后 7 d 创面组织中细胞间通信更多更密集(图 5A、5B)。热图显示,全层皮肤缺损小鼠伤后 7 d 创面组织中细胞间通信强度排前 3 位的细胞群为 dFb 亚群 C0、C1、C2(图 5C)。网络图进一步显示,在全层皮肤缺损小鼠伤后 7 d 创面组织中,dFb 亚群 C0、C1、C2 作为信号发送者,与组织中其他细胞群之间均有通信(图 5D、5E、5F)。
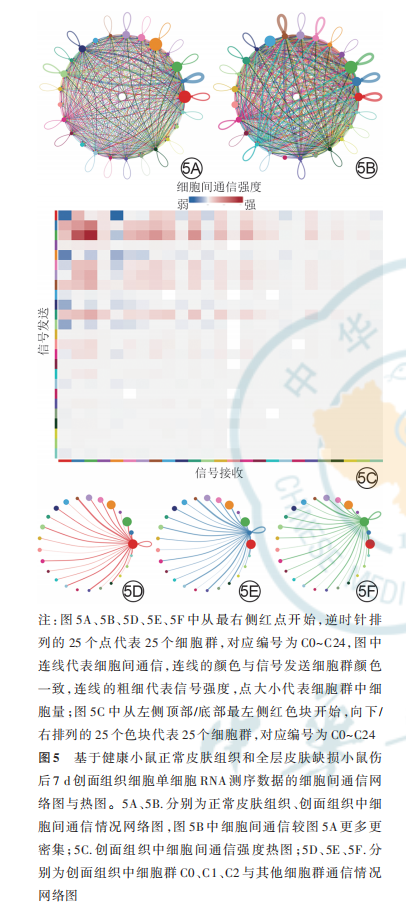
2. 4 细胞间的生长因子信号通路
对全层皮肤缺损小鼠伤后 7 d 创面组织的特定生长因子信号通路中细胞间通信的分析显示,在VEGF 信号通路中,主要信号发送者是 dFb 亚群 C0,主要信号接收者是脉管相关细胞群 C19 和 C21;在PDGF 信号通路中,主要由周细胞 C14 发送信号,多个 dFb 亚群 C0、C1、C2、C4、C5、C6、C7、C17 接收信号;在 EGF 信号通路中,主要由 KC 亚群 C9 和 C11 发送信号,主要由 dFb 亚群 C0 接收信号;在 FGF 信号通 路 中 ,主 要 信 号 发 送 者 和 接 收 者 均 为 dFb 亚 群C6。见图 6。

2. 5 FGF 信号通路下细胞间通信
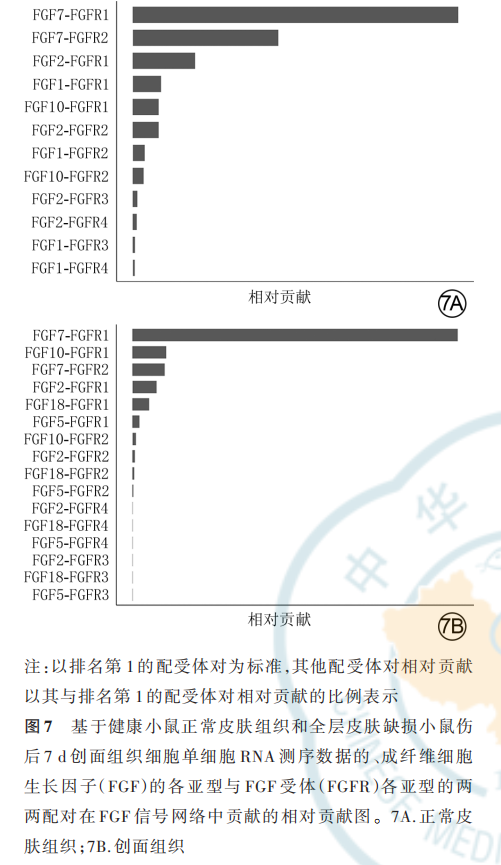
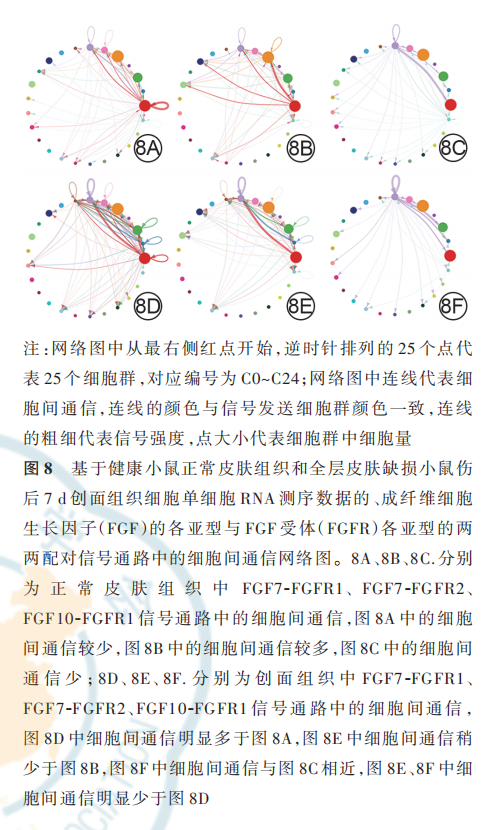
FGF 配受体对相对贡献分析可见,健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后 7 d 创面组织中,均是 FGF7-FGFR1 排在首位;正常皮肤组织中相对贡献排名第 2 的是 FGF7-FGFR2,然而该 FGF 配受体对在创面组织中的排名降低;正常皮肤组织中相对贡献排名第 5 的 FGF10-FGFR1 在创面组织中的排名上升至第 2 位,但与创面组织中排名第 1 的FGF7-FGFR1 差距较大。见图 7。网络图进一步显示,与健康小鼠正常皮肤组织比较,全层皮肤缺损小鼠伤后 7 d 创面组织 FGF7-FGFR1 信号通路中的细胞间通信更多,而 FGF7-FGFR2 和 FGF10-FGFR1信号通路中的细胞间通信稍有减少或无明显变化;创面组织FGF7-FGFR1 信号通路中的细胞间通信强于 FGF7-FGFR2、FGF10-FGFR1 信 号 通 路 ;在 健 康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后 7 d 创面 组 织 中 ,FGF7 信 号 均 主 要 由 dFb 亚 群 C0、C1、C2 发出,主要由 dFb 亚群 C6、C7 接收。见图 8。
2. 6 FGF7 蛋白表达与分布及其与另外 4 种 dFb 标志蛋白的共定位表达
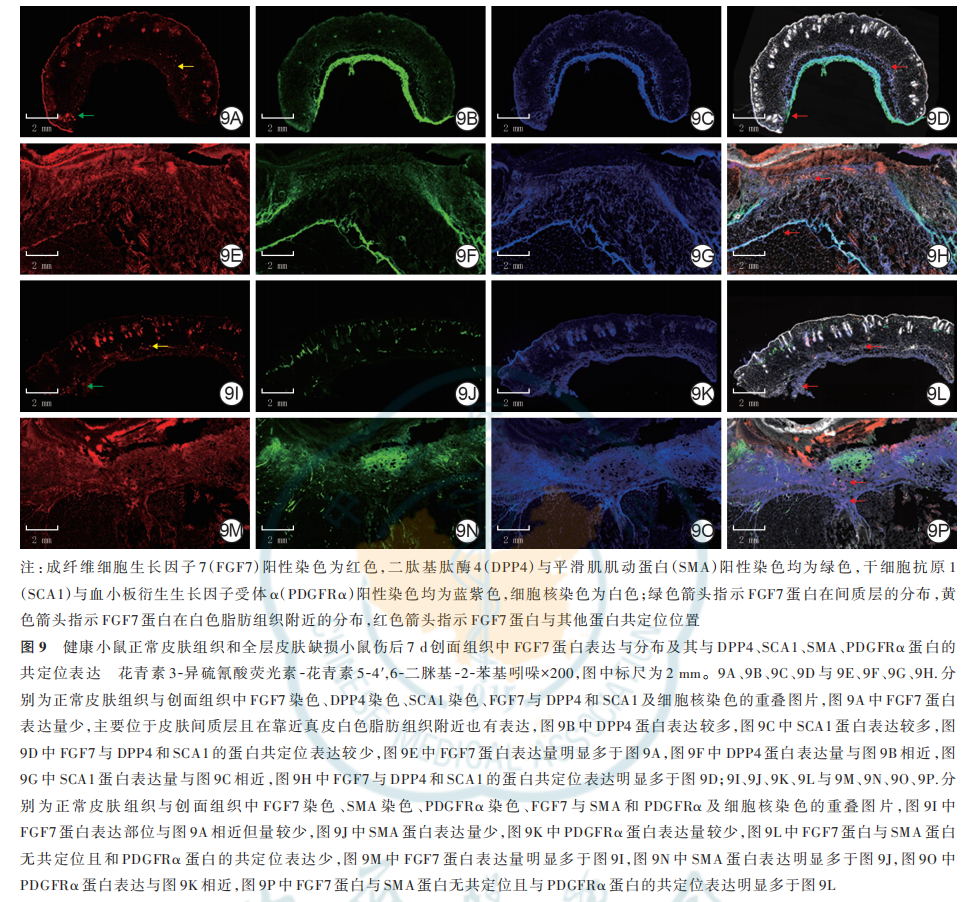
与健康小鼠正常皮肤组织比较,全层皮肤缺损 小鼠伤后 7 d 创面组织中 FGF7 蛋白表达更多;在正常皮肤组织中,FGF7 蛋白主要表达于皮肤间质层且在靠近真皮白色脂肪组织附近也有表达;在 2 种组织中,FGF7 蛋白与 DPP4、SCA1 蛋白共定位表达于皮肤间质层中,与 PDGFRα 蛋白共定位表达于 dFb中,与 SMA 蛋白无共定位表达,其中创面组织中的共定位表达多于正常皮肤组织。见图 9。
3 讨论
皮肤创面修复是一个复杂的过程,有多种细胞参与;单细胞 RNA 测序技术的发展和应用,使研究者 可 以 从 新 的 层 面 认 识 细 胞 的 多 样 性 。 Haensel等[22] 通过对全层皮肤缺损小鼠伤后 4 d 创面组织的单细胞 RNA 测序并结合上皮相关细胞的重分群和分析,揭示了创面愈合过程中上皮细胞的异质性和分化轨迹;Guerrero-Juarez 等[23] 通过对全层皮肤缺损小鼠伤后 12 d 的创面组织进行单细胞 RNA 测序,探讨了创面重塑期 dFb 的组成和脂肪祖细胞分化来源。本研究则聚焦于增殖期的创面组织中细胞间的生长因子通信网络,通过单细胞 RNA 测序分析,定义了增殖期创面组织中的各细胞类型,并且对于dFb 的异质性有了新的了解。
本研究的单细胞 RNA 测序结果可视化后,每种标志基因指示的不同皮肤细胞群在二维 tSNE 云图上都有各自明确的分布,基本不互相串扰,说明该次单细胞 RNA 测序完成度高,为之后的深入分析提供 了 保 障 。 本 研 究 团 队 定 义 的 dFb 亚 群 C0 与Merrick 等[27] 报道的间质祖细胞相似,高表达 Wnt2、淋巴细胞抗原 6A 和 DPP4 基因,其他的各 dFb 亚群含有成脂、基质合成和增殖等多方面基因的表达。该结果加深和扩宽了目前对于 dFb 异质性和多向分化潜能的认识。
细 胞 间 通 信 是 多 细 胞 彼 此 协 调 运 作 的 基 础 。本研究通过 CellChat 软件构建了细胞间通信网络,了解到与健康小鼠正常皮肤组织相比,全层皮肤缺损小鼠伤后 7 d 创面组织中细胞间的通信更密集、强度更大,说明该生理情况下细胞间交流更紧密和复杂。推测在创面愈合过程中,细胞间依赖生长因子/细胞因子信号的传递,互为调控,驱动细胞功能的发挥和分化,以保证创面修复有序完成。进一步分 析 显 示 ,dFb 亚 群 C0、C1、C2 的 通 信 强 度 排 前3 位,且这 3 个 dFb 亚群与创面组织中其他细胞群之间均存在通信联系。以上分析说明 dFb 是创面愈合过程中的重要信号枢纽之一。之后,本研究重点关注了 VEGF、PDGF、EGF、FGF 家族这几个创面修复相关因子的潜在作用靶点[28⁃29],分析结果显示 dFb是多个生长因子网络的信号发送者或接收者,不同的 dFb 亚群在不同生长因子信号通路中扮演着不同角色,再次说明了 dFb 的高异质性,且说明该细胞群既是多种生长因子信号通路调控的靶点,也是信号进一步互相传递的重要承载单元。
FGF 家族有多个成员,在创面修复中起重要作用,例如 FGF1、FGF2、FGF7、FGF10、FGF18 等,都已经 有 创 面 修 复 有 关 的 临 床 和 基 础 研 究 报 道[30⁃31]。FGF2 与肿瘤血管形成有关[32],FGF3 在小细胞肺癌和肝癌中高表达等[33⁃34]。因此,鉴于 FGF 信号的多样和复杂性,以及潜在的巨大临床价值,本研究进一步深入分析了创面组织中的各细胞群 FGF 信号交流情况。与过往研究相符,在该次研究中也观察到 FGF 信号通路中,主要由 dFb 亚群起作用。正常皮肤组织和创面组织中都是 FGF7-FGFR1 对 FGF 信号网络贡献最大,但创面组织 FGF7-FGFR1 信号通路中细胞间通信明显强于正常皮肤组织,而 2 种组织的 FGF7-FGFR2 和 FGF10-FGFR1 信号通路中细胞间通信差异不大,这说明 FGF7-FGFR1 可能在创面 修 复 中 发 挥 主 要 作 用 。 此 外 ,之 前 报 道 提 及FGF7 主 要 靶 向 KC[35⁃37],但 本 次 研 究 显 示 皮 肤 中FGF7 信号接收者也主要是 dFb 群,展示了 FGF7 潜在新的靶向性。
本研究通过多重免疫荧光染色 ,进 一 步 明 确FGF7 蛋白的定位和表达。在创面组织中,FGF7 蛋白与标记间质祖细胞的 DPP4、SCA1 蛋白有共定位表达,这与细胞间通信分析中 FGF7 信号主要由间质祖细胞发送相符;在正常皮肤组织中,FGF7 蛋白还表达于真皮白色脂肪组织附近,该位置远离表皮层,暗示了这些 FGF7 可能有助于脂肪分化,这也与细胞间通信分析中 FGF7 信号主要由定向脂肪细胞接 收 相 符 。 此 外 ,创 面 组 织 中 ,FGF7 蛋 白 与 标 记dFb 的 PDGFRα 蛋白有共定位表达,但与标记肌 Fb与血管平滑肌细胞的 SMA 蛋白无共定位表达,这与细胞间通信分析中,FGF7 信号也基本不来自于具有收缩能力的肌肉细胞相关 Fb 的测序结果相符。以上组织染色结果基本与单细胞 RNA 测序分析结果相符,初步揭示了皮肤创面愈合过程中,FGF 信号对dFb 重要的调控作用以及 FGF7 在 dFb 中新的潜在调控路径。
综上,本研究使用单细胞 RNA 测序技术,展示了 dFb 的高异质性以及在创面修复时生长因子信号通路中 dFb 的核心位置;进一步探讨了创面修复中的 FGF 信号通路并结合组织多重免疫荧光染色技术,明确了 FGF7 信号在创面修复中的潜在调控作用。本研究显示,间质祖细胞是表达 FGF7 的主要细胞群,该细胞群具有脂肪干细胞特征,具有很强的再生脂肪能力[27],而目前在临床创面修复和医疗美 容 领 域 ,脂 肪 干 细 胞 的 应 用 越 来 越 多 。 因 此 ,FGF7 的高表达或许是脂肪干细胞促创面修复的原因之一,后期研究可进一步探讨 FGF7 及其他 FGF亚型如何调控 dFb 表型和参与细胞间通信,为 FGF等生长因子的后续研究以及推动脂肪干细胞的临床应用提供一定的前期基础和支持。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 孙礼祥:实验操作、数据整理、论文撰写、经费支持;
吴帅:数据处理与论文撰写;张小薇:实验操作;刘文杰:论文修改;
张凌娟:研究指导、论文修改、经费支持
参考文献
[1] Gallo RL,Hooper LV.Epithelial antimicrobial defence of the skin and intestine[J]. Nat Rev Immunol, 2012, 12(7): 503 -516. DOI: 10.1038/nri3228.
[2] Cañedo-Dorantes L,Cañedo-Ayala M.Skin acute wound healing: a comprehensive review[J].Int J Inflam,2019,2019:3706315.DOI: 10.1155/2019/3706315.
[3] Sorg H,Tilkorn DJ,Hager S,et al.Skin wound healing: an update on the current knowledge and concepts[J]. Eur Surg Res, 2017,58(1/2):81-94.DOI:10.1159/000454919.
[4] Grennan D.Diabetic foot ulcers[J].JAMA, 2019, 321(1): 114.DOI:10.1001/jama.2018.18323.
[5] Han G, Ceilley R. Chronic wound healing: a review of current management and treatments [J]. Adv Ther , 2017, 34(3): 599 -610. DOI:10.1007/s12325 -017-0478 -y.
[6] Alster TS,Tanzi EL.Hypertrophic scars and keloids: etiology and management[J]. Am J Clin Dermatol , 2003 , 4(4): 235 -243. DOI: 10.2165/00128071 -200304040-00003.
[7] Kischer CW, Thies AC, Chvapil M. Perivascular myofibroblasts and microvascular occlusion in hypertrophic scars and keloids [J]. Hum Pathol , 1982, 13(9): 819 -824.DOI: 10.1016/s0046-8177(82) 80078-6.
[8] Barrientos S,Stojadinovic O,Golinko MS,et al.Growth factors and cytokines in wound healing[J].Wound Repair Regen,2008,16(5): 585-601.DOI:10.1111/j.1524-475X.2008.00410.x.
[9] Amiri N, Golin AP, Jalili RB, et al. Roles of cutaneous cell-cell communication in wound healing outcome: an emphasis on keratinocyte-fibroblast crosstalk[J]. Exp Dermatol, 2022, 31(4): 475-484.DOI:10.1111/exd .14516.
[10]Han CM , Cheng B , Wu P. Clinical guideline on topical growth factors for skin wounds [J/OL]. Burns Trauma, 2020 ,8: tkaa035[2022-02-15]. https ://pubmed . ncbi. nlm.nih. gov/ 33015207/.DOI:10.1093/burnst/tkaa035.
[11] Zubair M, Ahmad J. Role of growth factors and cytokines in diabetic foot ulcer healing: a detailed review [J]. Rev Endocr Metab Disord,2019,20(2):207 -217.DO I: 10.1007 /s11154 -019- 09492-1.
[12] Wei Y,Li J,Huang Y,et al.The clinical effectiveness and safety of using epidermal growth factor , fibroblast growth factor and granulocyte-macrophage colony stimulating factor as therapeutics in acute skin wound healing : a systematic review and meta -analysis[J/OL].Burns Trauma,2022 ,10:tkac002[2022-02-15]. https://pubmed. ncbi. nlm. nih. gov/35265723/. DOI:10.1093/burnst/tkac002.
[13] Chen K,Rao Z,Dong S,et al.Roles of the fibroblast growth factor signal transduction system in tissue injury repair[J/OL]. Burns Trauma,2022,10:tkac005[2022-02-15]. https://pubmed.ncbi.nlm. nih.gov/35350443/.DOI:10.1093/burnst/tkac005.
[14] Liu Y,Liu Y,Deng J,et al.Fibroblast growth factor in diabetic foot ulcer: progress and therapeutic prospects[J]. Front Endocrinol(Lausanne),2021 ,12 : 744868 .DOI:10.3389 /fendo .2021. 744868.
[15] Hui Q ,Jin Z , Li X , et al . FGF family : from drug development to clinical application [J]. Int J Mol Sci , 2018 , 19 (7): 1875 . DOI : 10.3390/ijms19071875.
[16] Krook MA, Reeser JW, Ernst G, et al. Fibroblast growth factor receptors in cancer: genetic alterations, diagnostics, therapeutic targets and mechanisms of resistance [J].Br J Cancer ,2021,124(5): 880 -892.DOI:10.1038/s41416-020-01157 -0.
[17] Tracy LE, Minasian RA, Caterson EJ. Extracellular matrix and dermal fibroblast function in the healing wound [J]. Adv Wound Care (New Rochelle),2016,5(3):119 -136.DO I:10.1089 /wound.2014.0561.
[18]desJardins -Park HE, Foster DS , Longaker MT. Fibroblasts and wound healing : an update [J]. Regen Med , 2018 , 13(5): 491-495. DOI:10.2217 /rme -2018 -0073.
[19] Driskell RR, Lichtenberger BM,Hoste E, et al.Distinct fibroblast lineages determine dermal architecture in skin development and repair[J].Nature,2013,504(7479):277 -281.DO I: 10.1038/nature 12783.
[20] Tabib T, Morse C, Wang T, et al. SFRP2/DPP4 and FMO1/LSP1 define major fibroblast populations in human skin [J]. J Invest Dermatol,2018,138(4):802 -810.DOI:10.1016/j.jid.2017 .09 .045.
[21] Zhang Z,Shao M,Hepler C, et al.Dermal adipose tissue has high plasticity and undergoes reversible dedifferentiation in mice [J].J Clin Invest,2019,129(12):5327 -5342.DOI:10.1172/JCI130239.
[22] Haensel D,Jin S,Sun P,et al.Defining epidermal basal cell states during skin homeostasis and wound healing using single-cell transcriptomics[J]. Cell Rep, 2020, 30(11): 3932-3947. e6. DOI: 10.1016/j.celrep.2020.02.091.
[23] Guerrero-Juarez CF, Dedhia PH,Jin S, et al. Single-cell analysis reveals fibroblast heterogeneity and myeloid -derived adipocyte progenitors in murine skin wounds [J]. Nat Commun , 2019, 10(1): 650.DOI:10.1038/s41467 -018-08247 -x
[24] Zhang LJ,Chen SX,Guerrero-Juarez CF,et al.Age-related loss of innate immune antimicrobial function of dermal fat is mediated by transforming growth factor beta [J]. Immunity , 2019, 50(1): 121 -136.e5.DOI:10.1016/j.immuni.2018 .11 .003.
[25] Zhang X, Lan Y, Xu J, et al. CellMarker: a manually curated resource of cell markers in human and mouse [J]. Nucleic Acids Res,2019,47(D1):D721 -D728.DOI:10.1093/nar/gky900.
[26] Jin S ,Guerrero-Juarez CF,Zhang L ,et al .Inference and analysis of cell -cell communication using CellChat [J]. Nat Commun , 2021, 12(1):1088.DOI:10.1038/s41467 -021 -21246 -9.
[27] Merrick D, Sakers A, Irgebay Z, et al. Identification of a mesenchymal progenitor cell hierarchy in adipose tissue[J]. Science, 2019, 364(6438): eaav2501. DOI: 10.1126/science.
[28] Berry-Kilgour C,Cabral J,Wise L.Advancements in the delivery of growth factors and cytokines for the treatment of cutaneous wound indications [J]. Adv Wound Care ( New Rochelle), 2021,10(11):596-622.DOI:10 .1089/wound.2020
[29] Yamakawa S, Hayashida K.Advances in surgical applications of growth factors for wound healing [J/OL]. Burns Trauma , 2019, 7 : 10[2022 -02-15]. https ://pubmed . ncbi. nlm . nih. gov/30993143/ . DOI:10.1186/s41038 -019 -0148- 1.
[30]Maddaluno L,Urwyler C,Werner S.Fibroblast growth factors: key players in regeneration and tissue repair [J]. Development, 2017,144(22): 4047 - 4060.DOI :10 .1242 /dev.152587.
[31] Xie Y, Su N, Yang J , et al. FGF/FGFR signaling in health and disease[J]. Signal Transduct Target Ther , 2020, 5(1): 181. DOI: 10.1038/s41392 -020-00222-7.
[32] Lindner V,Majack RA,Reidy MA.Basic fibroblast growth factor stimulates endothelial regrowth and proliferation in denuded arteries[J]. J Clin Invest, 1990, 85(6): 2004 -2008. DOI: 10.1172/
[33] Tai AL, Sham JS, Xie D, et al. Co-overexpression of fibroblast growth factor 3 and epidermal growth factor receptor is correlated with the development of nonsmall cell lung carcinoma [J].Cancer,2006,106(1):146 -155.DOI:10.1002/cncr.21581.
[34] Hu L, Sham JS, Xie D, et al. Up-regulation of fibroblast growth factor 3 is associated with tumor metastasis and recurrence in human hepatocellular carcinoma[J]. Cancer Lett, 2007, 252(1): 36-42 .DOI :10.1016 /j.canlet. 2006 . 12.003 .
[35]Yen TT ,Thao DT ,Thuoc TL. An overview on keratinocyte growth factor : from the molecular properties to clinical applications [J]. Protein Pept Lett,2014,21(3):306 - 317 .DOI :10.2174/0929866511
[36] Werner S, Krieg T, Smola H. Keratinocyte-fibroblast interactions in wound healing[J]. J Invest Dermatol, 2007, 127(5): 998 -1008. DOI:10.1038/sj.jid.5700786.
[37] Zinkle A,Mohammadi M.Structural bology of the FGF7 subfamily [J].Front Genet,2019,10:102.DOI:10.3389/fgene.2019.00102.
本文包括图片转载于中华烧伤与创面修复杂志 2022 年 7 月第 38 卷第 7 期,不代表本公众号赞同其观点和对其真实性负责。我们用于阅读分享,非商业用途,如若侵权,请告知删除。


