慢性伤口、大面积烧伤已逐渐成为全世界非常严重的健康问题与负担,临床治疗面临着许多困难和挑战。例如:当烧伤面积超过体表面积的75%时,由于自身缺乏健康的皮肤而需要同种异体移植,尽管如今许多公司提供同种异体移植物,但由于高昂的费用和有限的利用率而难以在临床上推广n,,因此寻求有效的治疗手段迫在眉睫。表皮干细胞(epidermal stem cells,ESCs)是皮肤自我更新和修复的工具,具有无限增殖和多向分化的潜能,这些特征使它在治疗皮肤疾病方面具有得天独厚的优势口,,给细胞疗法和再生医学注入了新的希望。认识ESCs的生物学特性有重要的意义,这样才可能研制出新的临床治疗方法,克服当前亟待解决的难题。
1、ESCs特征
表皮是哺乳动物皮肤的外衣,包括一个多层的上皮及毛囊、汗腺、皮脂腺等皮肤附属器。ESCs是表皮中的成体干细胞,聚集在干细胞龛中【3】,不断地更新表皮及皮肤附属器。具有慢周期性的ESCs受到刺激后产生了两种分裂方式,对称分裂生成两个ESCs,不对称分裂产生ESCs和短暂扩增细胞(transit amplifying cells,TACs)。Roshan等H1发现这两种方式是可以相互转化的,当到达某个“汇合点”后不对称分裂转化为对称分裂,从而维持内环境的稳态。TACs经过几代分裂后生成了终末分化细胞,这3种细胞构成了表皮增殖单位(epidermal proliferative unit,EPU)。
ESCs的命运受到遗传(如Sox2、Oct4)和环境因素的双重调节,使它表现出异质性,即ESCs在皮肤自我更新的过程中生成了具有不同分化能力的干细胞亚群【5】。ESCs对环境改变又呈现出可塑性,在正常的状态下,ESCs能分化成表皮、毛囊、皮脂腺、汗腺等,但在应激的状态下Escs能分化成皮肤的任何结构吲。例如:隆突部L铲5+ESCs只能分化成毛囊,但在皮肤修复的过程中,Lgr5+ESCs能分化成皮肤的任何结构。不仅如此,nestin+ESCs还可以分化成神经元细胞、神经胶质细胞、平滑肌细胞、心肌细胞、骨和软骨细胞【7】。
2、 ESCs亚群
根据所处位置不同把ESCs主要分为:毛囊干细胞(hair follicle stem cells,HFSCs)、皮脂腺干细胞(sebaceous gland stem cells,SGSCs)、毛囊间干细胞(interfollicle stem cells,IFSCs),nestin+毛囊相关多能干细胞(hair follicle associated—plu—ripotent stem cells,HAPs)。
2.1 HFSCs
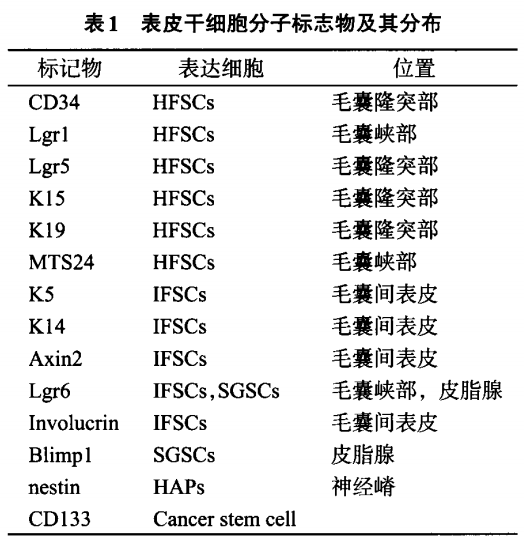
HFSCs位于毛囊隆突部及毛囊峡部,隆突部HFSCs表达CD34、Lgr5和K15,毛囊峡部HF.SCs表达Lgrl、MTS24【8】(如表1所示)。在毛囊生长初期,HFSCs分裂生成TACs,TACs迅速增殖成为成熟的毛囊。HFSCs经过几代分裂后毛囊进入静止期,毛囊下2/3的区域发生退化而隆突部保持完整。
2.2 IFSCs
IFSCs主要位于表皮基底膜,表达Intergrin 0【6、B1、CD71、Lgr6、Involucrinpl。EPU是由一个IFSCs、周围的大约10个TACs及多个定向细胞组成,呈六角形,当EPU中的细胞缺失时,由临近的EPU中的IFSCs来补充。IFSCs在伤口的再上皮化中发挥了重要的作用,IFSCs不断分化成角质细胞,角质细胞迁徙到伤口表面促成了伤口的再上皮化。
2.3 SGSCs
SGSCs位于隆突部之上的皮脂腺,表达Lgr6、Blimpl”“。Lgr6+的皮脂腺细胞源自于Blimpl+SGSCs,抑制Blimpl的表达会导致皮脂腺的增生【11】,表明Blimpl控制着SGSCs增殖分化。SGSCs的存在可以使皮脂腺长期地维持自我更新。当皮脂腺被破坏时,由HFSCs来维持皮脂腺的生长【12】。
2.4 HAPs
HAPs是近年来新发现的位于毛囊隆突部的nestin+的多能干细胞【13】,这类细胞表达CD34却不表达K15【14】。HAPs可以分化成神经元细胞、神经胶质细胞、平滑肌细胞、心肌细胞、骨和软骨细胞,还可以分化为毛囊、皮脂腺、汗腺等皮肤附属器。
3 ESCs增值分化所涉及的信号通路
3.1 Wnt-II.catenin通路
D—catenin是Wnt—pcatenin信号通路关键因子,当Wnt信号被激活后,13-catenin进入细胞核,与转录因子TCF/LEF形成复合体,激活如c.myc等靶基因【15】。wnt.B.catenin不仅在维持皮肤稳态、发育和伤口修复中发挥着重要的作用u61,而且还控制着ESCs的增殖分化【17】。Xu等【18】发现阻断或削弱Wnt信号后HFSCs开始定向分化,而增强Wnt通路HFSCs则可保持多能状态,表明Wnt.B.catenin通路有维持干细胞特性和控制干细胞定向分化的作用。
3.2 Shh通路
当无Shh信号时,Ptch与Smo结合,Smo活性被抑制,促进Gli的水解。当Shh与Ptch蛋白结合,Ptch与Smo蛋白分离,处于激活态的Smo抑制Gli转录因子的水解,Gli以全长的形式进入细胞核内诱导靶基因的表达。Ya等发现毛囊生长期Gli基因的表达明显多于静止期,Shh基因敲除的小鼠毛囊会停滞在静止期【19】。Shh神经源性阻断Shh通路促使HFSCs向IFSCs的转化【20】。这些研究说明Shh通路有调节毛囊生长周期的作用。
3.3 Notch通路
经典的Notch通路是在旁分泌的作用下完成信号转导的,信号接收细胞的Notch蛋白在信号发送细胞的jagged和Delta相互作用下被裂解,释放Notch胞内结构域(ICN),ICN进入细胞核,通过RBP相关分子结构域和锚蛋白重复序列结合蛋白,募集MAML蛋白,形成转录激活物,诱导靶基因如Hes/Hey的表达【21】。Lowell等∞1发现高表达DeltalESCs,对临近细胞的表达的Deltal不敏感,阻断了自身的Notch通路而保持分化性,同时通过自身高表达的Deltal使临近细胞分化成TACs。表明阻断Notch通路可以维持干细胞的特性,增强Notch通路可以促进干细胞的分化。Yang等【23】发现Notch通路在调节ESCs增殖、促进伤口愈合等发面发挥了重要作用。
wnt—D—catenin,Shh,Notch通路在调节ESCs增殖分化中占主导地位。p63、miRNA丝裂原活化的蛋白激酶、表皮生长因子等也发挥了重要的作用。大量的研究表明,丝裂原活化的蛋白激酶和表皮生长因子途径能促进ESCs的分化,尤其是IFSCs。
4、 ESCs的微环境
表皮干细胞壁龛(epidermal stem cell niche,ESCN)是ESCs集中存储的部位和所处的微环境,这个“结构”包括细胞外基质、基底膜、皮脂腺、毛囊隆突,还包括细胞之间的相互作用,如intergrin介导的细胞粘附、及复杂的信号次联反应,如Wnt.B.catenin通路调节ESCs的增殖分化【24】。ESCN在ESCs的生长、增殖、分化、迁移和组织的再生中发挥了重要的作用,此过程涉及复杂的分子信号通路以及基因表达产物【25】。小鼠模型中当RAS/MAPK或者Shh通路发生异常时,会导致鳞状细胞癌或者基底细胞癌的发生【26】,预示着异常的ESCN是肿瘤发生的一个原因。微环境是近年来干细胞研究的热点之一,因为干细胞疗法依赖于如何模拟合适的微环境从而在体外维持ESCs自我更新和高增殖力,只有研究清楚ES.CN对ESCs的调控机制,才能在体外更好地进行ESCs培养,进而使其分化产生所需要的特定功能的细胞及器官。
5、ESCs是皮肤非黑色素肿瘤细胞的起源
肿瘤的发生是遗传因素和环境因素相互作用的结果。ESCs在长期的紫外线暴露下发生了基因突变(如p53、Ras),或者在慢性炎症刺激下发生了重编程【27】,生成了肿瘤干细胞(cancer stem cells,CSCs),最终生成了肿瘤组织。CSCs是存在于肿瘤组织一小部分具有干细胞性质的群体,具有自我更新能力和多向分化能力,是肿瘤不断生长的根源。因此,肿瘤干细胞是临床治疗肿瘤的理想靶细胞。
基底细胞癌是最常见的皮肤非黑色素恶性肿瘤,大多数的基底细胞癌都表达Lgr5,而且基底细胞癌中有大量的突变型Ptchl(调节毛囊生长的Shh通路受体),表明隆突部的HFSCs是基底细胞癌的起源。起初,K5+K14+IFSCs被认为是鳞状细胞癌的起源,因为基底膜处的IFSCs易接收紫外线的照射而发生基因突变,并且基底膜处的IF.SCs易发生上皮一间质转化。但在小鼠的鳞状细胞癌模型中发现,CDl33+和Lgrl+癌细胞呈现出慢周期性、自我更新等干细胞的特点,K15+K19+HFSCs也能导致鳞状细胞癌的发生【28】,从而证实了鳞状细胞癌可能源于不同的干细胞亚群。随着年龄的增长,ESCs对DNA损伤修复的能力降低而发生DNA损伤的风险增加,恶性肿瘤发生的风险也越大【26】。这也就是皮肤恶性肿瘤为什么好发于50岁以上人群的原因之一。
6、 ESCs的临床应用
近年来,胚胎干细胞和间充质干细胞移植在再生医学中所取得的成功,让人们对ESCs有了更多的期待。ESCs移植在促进伤口愈合方面有着先天性的优势:(1)无限增殖和多向分化潜能;(2)更加能产生免疫耐受,无论是自体或者同种异体移植;(3)容易获取。Lough等旺卅用Lgr6+ESCs皮下注射于三度烧伤的小鼠伤口,发现能促进伤口愈合、毛囊生长、血管生成。尽管如今3D培养能使ESCs纯度提高、培养时间缩短【30】,细胞运动图像分析能鉴定ESCs亚群【31】,但由于ESCs缺乏特异性标志物而难以鉴定以及体外培养ESCs短时间内难以大量扩增使ESCs移植仍然面临着严峻的挑战,而且在移植过程中是否有致肿瘤发生的危险仍不清楚。
20世纪70年代Nyame等倡导表皮细胞体外培养形成皮肤替代物治疗大面积烧伤,用以预防感染和脱水,弥补了大面积烧伤患者存在自身供区不足及造成机体新的损伤等缺陷i321。ESCs因其无限增殖的特点可作为皮肤组织工程种子细胞的理想选择,但Xie等【33】在用ESCs构建组织工程皮肤治疗三度烧伤的裸鼠中发现重建的表皮缺乏皮脂腺、汗腺和其他皮肤附属器。遗感的是即使目前最先进的表皮替代物仍然缺乏皮肤附属器【1】,其中最可能的原因就是体外培养ESCs缺乏正常的ESCN。Ji等【34】用羊膜模拟ESCN培养ESCs发现培养时间明显缩短,细胞增值率显著提高。诱导多能干细胞为皮肤附属器的再生带来了希望,该技术通过对间充质干细胞的重编程直接形成汗腺样细胞【35】,从而弥补了ESCs构建皮肤代替物技术的不足。
ESCs也是治疗皮肤遗传性疾病的首选靶细胞,Warrick等【36】用载有XPC基因的逆转录病毒转染着色性干皮病患者的ESCs,体外器官型培养呈现出正常的增殖、分化和分层等特点。Lathion等【37】用载有COL7A1基因的逆转录病毒转染营养不良性大泡型表皮松懈症患者的ESCs,发现COL7A1+ESCs能在体外形成全克隆,然后移植于SCID小鼠,1年后小鼠皮肤仍能呈现出自我更新的能力,并且无肿瘤发生。这些研究结果都预示着ESCs在基因疗法中的巨大潜能。
ESCs在其他方面也有着广阔的发展前景。Amoh等081用HAPs移植于坐骨神经损伤的小鼠,2个月后发现HAPs分化成神经膜细胞,并且在轴突周围形成了髓鞘;Hu等【38】用HAPs移植于脊髓横断的小鼠,通过脊髓躯体感觉诱发电位检测发现小鼠的感觉提升了24%,表明HAPs能促进神经的再生以及促进脊髓损伤的愈合。
7、 结论
ESCs的研究始于20世纪60年代,如今发展了大半个世纪。ESCs作为干细胞群中的一份子,既保留了干细胞的一些基本特征,还具有自身独有的特征,因此ESCs成为临床各个学科研究的热点之一。近年来ESCs在基础医学领域取得了显著的研究成果,但是仍然没有临床试验。ESCs的研究仍处于初级阶段,面临着诸多挑战:ESCN与组织再生的关系仍不清楚;ESCs和皮肤肿瘤发生存在怎样的关系;ESCs自体移植中皮肤附属器为何难以再生;如何在体外模拟出理想的ES—CN。进一步了解ESCs的这些生物特性,有助于更好地治疗皮肤疾病和肿瘤。
参考文献
[1] Chua AWC,Cheong KY,Keem TB,et a1.Skin tissue engi—neenng advances in severe bums:review and therapeutic applications[J].Bums&Trauma,2016,4(1):1一14
[2] Pastushenko I,Prieto-Torres L,Gilaberte Y,et a1.Skin stem cells:at the frontier between the laboratory and clinical practice:Part 1.epidermal stem cells[J].Actas Dermosifiliogr,2015.106(9):725—-732
[3] Choi HR,Byun SY,Kwon SH,et a1.Niche interactions in epidermal stem cells[J].World J Stem Cells,2015,7(2):495—501
[4] Roshan A,Murai K,Fowler J,et a1.Human keratinocytes have two interconvertible modes of proliferation[J].Nat Cell Biol,2016,18r2):145—156
[5] Donati G,Watt FM.Stem cell heterogeneity and plasticity in epithelia[J].Cell Stem Cell,2015,16(5):465—476
[6] Eckert RL,Adhikary G,Gautam S,et a1.Biochemistry of epidermal stem cells[J].Biochimica et Biophysica Acta (BBA)一General Subjects,2013,1830(2):2427--2434
[7] Hoffman RM.Introduction to hair-follicle-associated pluripotent stem cells[J].Methods Mol Biol,2016,1453:1--5
[8] Bose A,Teh MT’MackenzieI C,et a1.Keratin k1 5 as a biomarker of epidermal stem cells[J].Int J Mol Sci,2013,14(10):19385--19398
[9] Fullgrabe A,Joost S,Are A,et a1.Dynamics of Lgr6(+)progenitor cells in the hair follicle,sebaceous gland,and interfollicular epidermis[J].Stem Cell Reports,2015,5(5):843—855
[10] Ohe S,Tanaka,TYanai H,et a1.Maintenance of sweat glands by stem cells located in the acral epithelium[J].Biochem Biophys Res Commun,2015,466(3):333--338
[11] Horsley v,O’Carroll D,Tooze R,et a1.Blimpl defines a progenitor population that govems cellular input to the sebaceous gland[J].Cell,2006,126(3):597—609
[12] Rompolas P,Greco V Stem cell dynamics in the hair follicle niche[J].Seminars in Cell&Developmental Biolo—gY,2014.25—26:34—42
[13] Hoffman RM.Nestin·expressing hair follicle-accessible pluripotent stem cells for nerve and spinal cord repair[J].Cells Tissues Organs,2014,200(1):42—-47
[14] Sagha M,Najafzadeh N.Highly efficient neural differentiation of CD34-·positive hair-follicle··associated pluripo—tent stem cells induced by retinoic acid and serum-free medium[J].Methods Mol Biol,2016,1453:161~172
[15] Shi Y Shu B,Yang R,et a1.Wnt and Notch signaling pathway involved in wound healing by targeting c-Myc and Hesl separately[J].Stem Cell Res Ther,2015,6:120
[16] Augustin I.Wnt signaling in skin homeostasis and pathol—ogy[J].J Dtsch Dermatol Ges,2015,13(4):302--306
[17] Houschyar KS,Momeni A,Pyles MN,et a1.Wnt signal-ing induces epithelial differentiation during cutaneous wound healing[J].Organogenesis,2015,ll(3):95—104
[18] Xu Z,Wang W,Jiang K,et a1.Embryonic aRenuated Wnt/beta-catenin signaling defines niche location and long—term stem cell fate in hair follicle[J].Elife,201 5,4:e10567
[19] Hsu YC,L Li,Fuchs E.Transit·amplifying cells orchestrate stem cell activity and tissue regeneration[J].Cell,2014,157(4):935—949
[20] Petrova R,Joyner AL.Roles for Hedgehog signaling in adult organ homeostasis and repair[J].Development, 2014,141(18):3445--3457
[21] Koch U,Lehal R,Radtke F.Stem cells living with a Notch[J].Development,2013,140(4):689—704
[22] Lowell S,Jones P'Le Roux I,et a1.Stimulation of hu.man epidermal differentiation by delta—notch signalling at the boundaries ofstem—cell clusters[J].Curr Biol,2000,10(9):49l一500
[23] Yang RH,Qi SH,Shu B,et a1.Epidermal stem cells (ESCs)accelerate diabetic wound healing via the Notch signalling pathway[J].Biosci Rep,2016.DOI:10.1042/ BSR20160034
[24] Watt FM.Mammalian skin cell biology:at the interface between laboratory and clinic[J].Science,2014, 346(62 1 2):937—940
[25] Rompolas P'Greco V Stem cell dynamics in the hair follicle niche[J].Semin Cell Dev Biol,2014,25—_26:34—-42
[26] Lacina L,Plzak J,Kodet O,et a1.Cancer microenviroment:what can we learn from the stem cell niche[J].Int J Mol Sci,2015,16(10):24094--241 10
[27] Song IY,Balmain A.Cellular reprogramming in skin cancer[J].Seminars in Cancer Biology,201 5.32:32—-39
[28] Patel GK,Yee C F’Terunuma A,et a1.Identification and characterization of tumor-initiating cells in human primary cutaneous squamous cell carcinoma[J].Journal of Investigative Dermatology,2012.132(2):401—-409
[29] Lough DM,Yang M,Blum A,et a1.Transplantation of the LGR6+epithelial stem cell into full··thickness cutaneous wounds results in enhanced healing,nascent hair follicle development,and augmentation of angiogenic analyres[J].Plast Reconstr Surg,2014,133(3):579-一590
[30] Knight E,Przyborski S.Advances in 3D cell culture technologies enabling tissue-like structures to be created in vitro[J].J Anat,2015,227(6):746_一756
[31 ] Nanba D,Toki F,Tate S,et a1.Cell motion predicts human epidermal stemness[J].J Cell Biol,2015,209(2):305—315
[32] Nyame TT,Chiang HA,LeaviR T’et a1.Tissue· engineered skin substitutes[J].Plast Reconstr Surg.2015.136(6):137争一1388
[33] Xie儿,Li TZ,Qi SH,et a1.A study of using tissueengineered skin reconstructed by candidate epidermal stem cells to cover the nude mice with full.thickness skin defect[J].J Plast Reconstr Aesthet Surg,2007,60 (9):983—_990
[34] Ji SZ,Xiao SC,Luo PF’et a1.An epidermal stem cells niche microenvironment created by engineered human amniotic membrane[J].Biomaterials,201l,32(31):7801—-7811
[35] Zhang C,Chen YFu X.Sweat gland regeneration+after bum injury:is stem cell therapy a new hope?[J].Cytotherapy,2015,17(5):526—535
[36] Warrick E,Garcia M,Chagnoleau C,et a1.Preclinical corrective gene transfer in xeroderma pigmentosum human skin stem cells[J].Mol Ther,2012,20(4):798—807
[37] Lathion S,Droz G,Blanpain C,et a1.A single epidermal stem cell strategy for safe ex vivo gene therapy[J].EMB0 Mol Med,2015,7(4):380一393
[38] Amoh Y,Katsuoka I(,Hoffman RM.Peripheral-nerve and spinal·-cord regeneration in mice using hair-follicle--associated pluripotent(HAP)stem cells[J].Methods Mol Biol,2016,1453:21—32
[39] Hu YF'Gourab K,Wells C,et a1.Epidermal neural crest stem cell(EPI·-NCSC)··mediated recovery of sensory function in a mouse model of spinal cord injury[J].Stem Cell Rev,2010,6(2):186—198
本文献包括图片转载于兰州大学学报(医学版)第43卷第1期,不代表本网站赞同其观点和对其真实性负责,我们主要用于阅读分享,非商业用途,如若侵权,请告知删除。


