
伤口世界
电子邮件地址: 该Email地址已收到反垃圾邮件插件保护。要显示它您需要在浏览器中启用JavaScript。


- 星期一, 29 9月 2025
Investigation of the anti-skin aging effects of taurine through mendelian randomization analysis of its relationship with immune cells





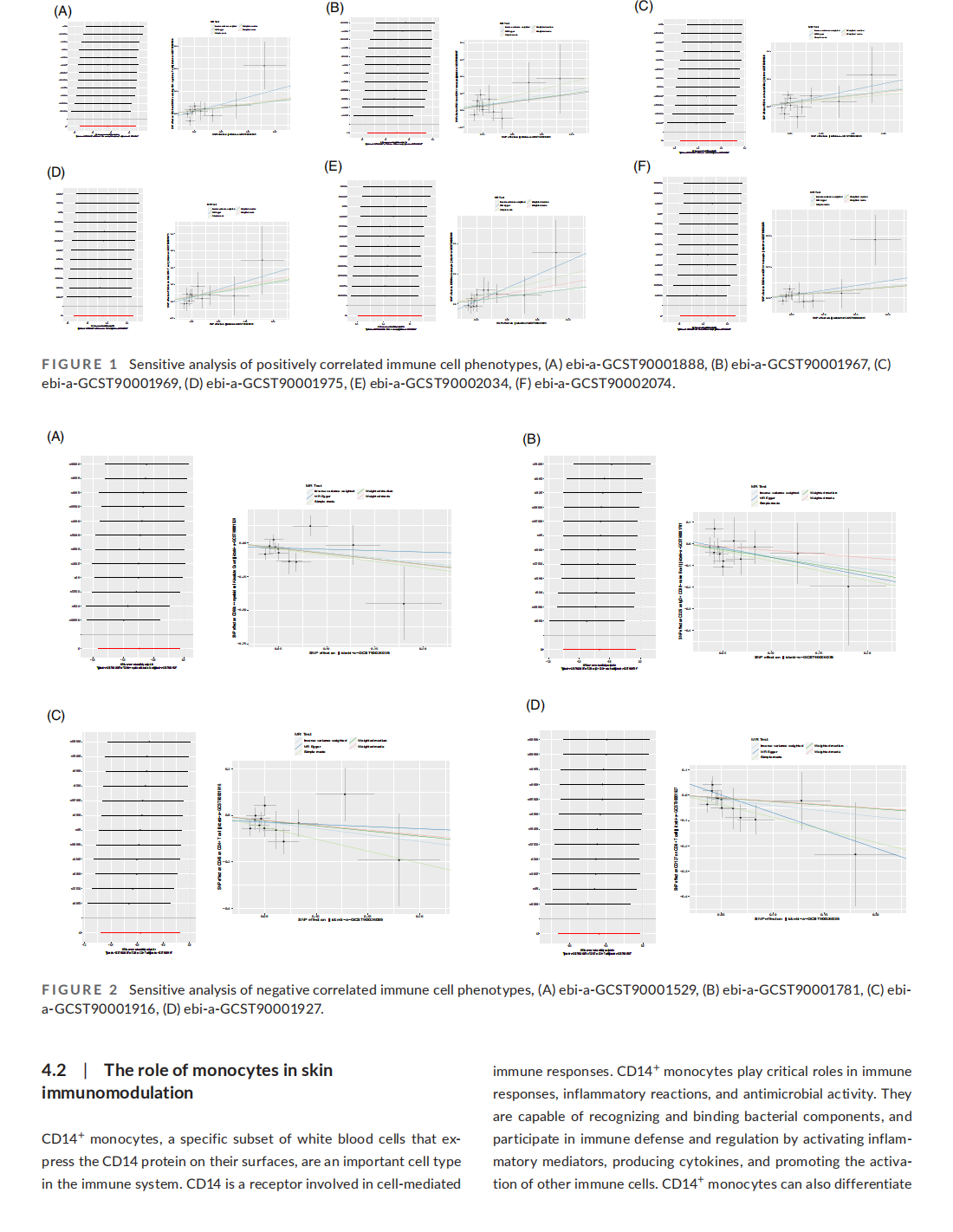


his article is excerpted from the《Journal of Cosmetic Dermatology》by Wound World

- 星期日, 28 9月 2025
Anti-aging and immunomodulatory role of caffeine in Drosophila larvae




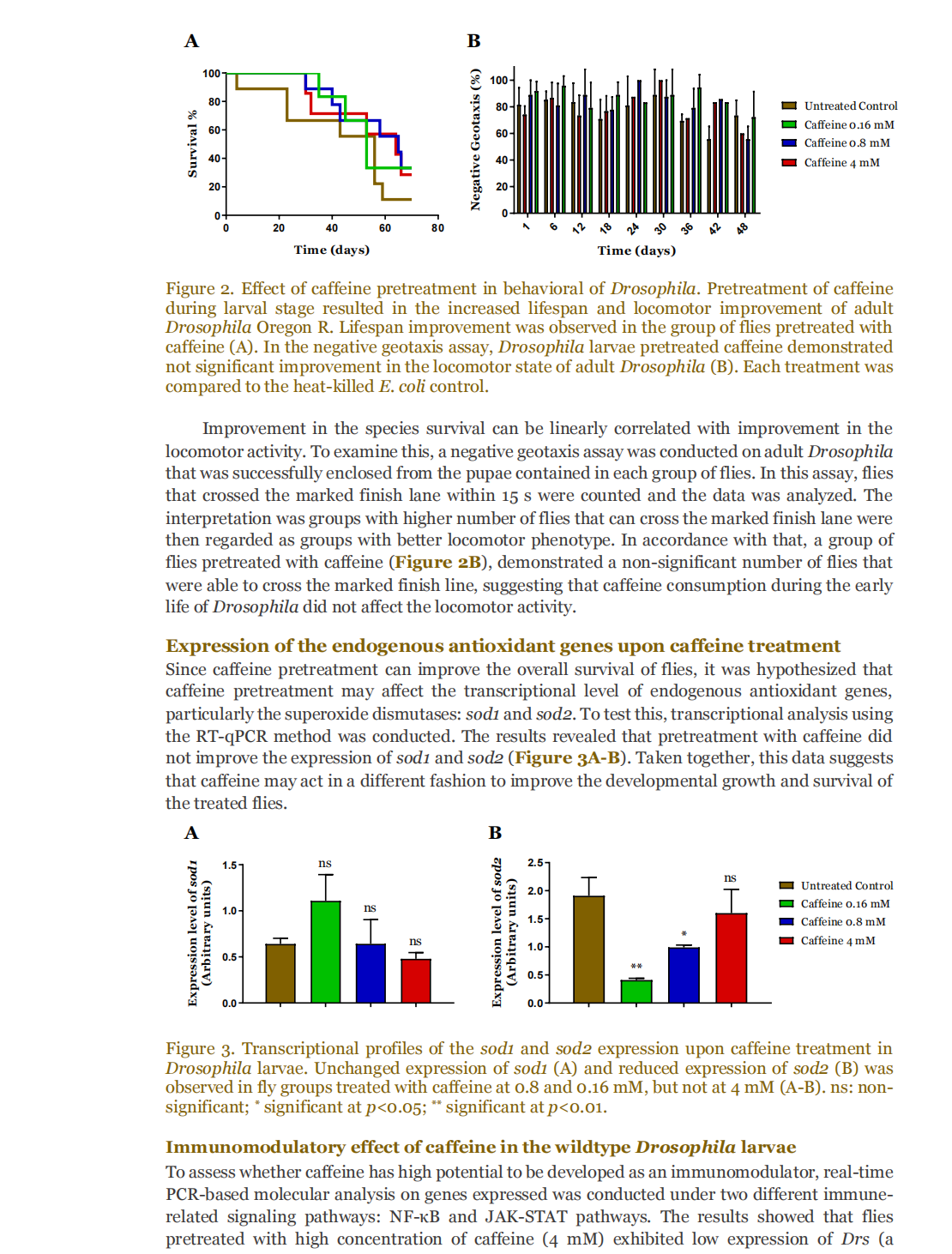
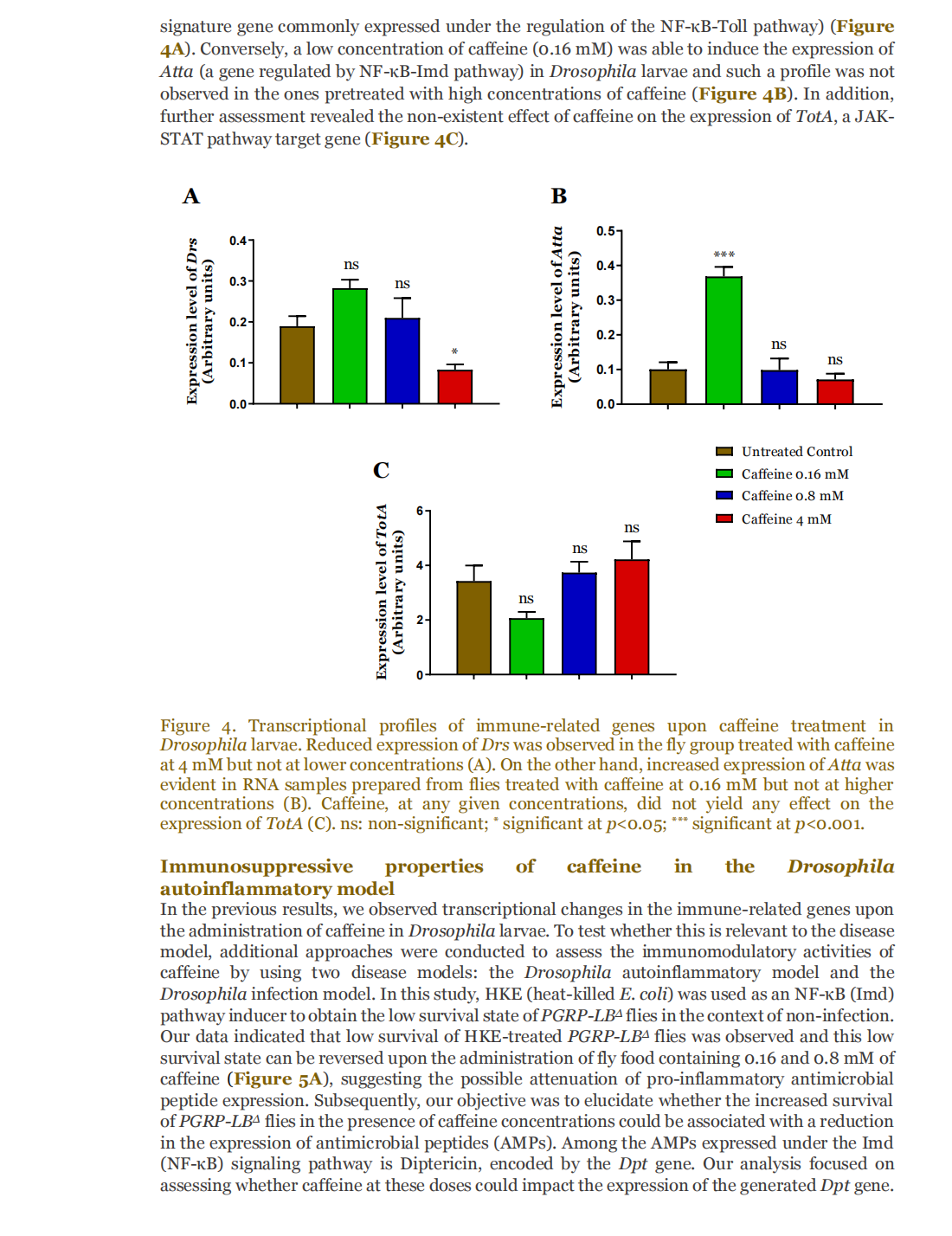
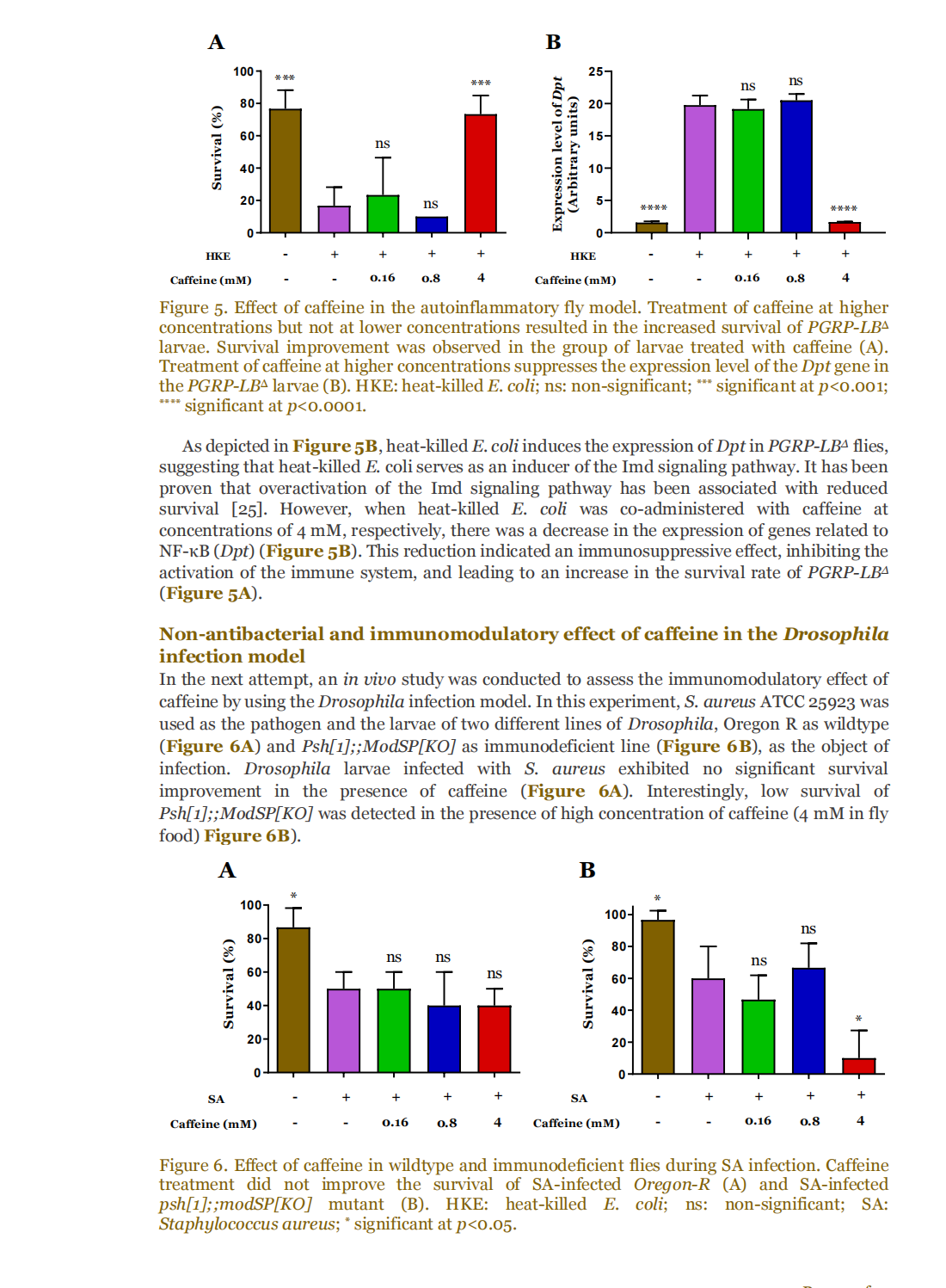




This article is excerpted from the 《Small Science》 by Wound World







